CRISPR-Cas系统是存在于原核生物(细菌和古菌)中的一类古老的免疫系统,用于抵御防御外源遗传元件(例如噬菌体)入侵。通过对该系统的研究,科学家们开发出了一系列强大的基因编辑工具,例如CRISPR-Cas9,其通过RNA引导的Cas9核酸酶,对DNA进行切割,实现基因组编辑。

除了原核生物外,科学家们还发现,许多病毒(噬菌体)中也存在CRISPR系统。那么,真核生物中是否也存在类似CRSIPR的系统呢?
2023年6月28日,张锋团队在 Nature 期刊发表了题为:Fanzor is a eukaryotic programmable RNA-guided endonuclease 的研究论文【1】。
研究团队在真核生物中发现了第一个RNA引导的DNA切割酶——Fanzor,更重要的是,这种新型CRISPR样系统,可以在重编程后实现对人类基因组的编辑。
此外,相比CRISPR-Cas系统,Fanzor系统非常紧凑,更容易递送到细胞和组织中。而且,Fanzor系统没有旁系切割活性,可实现更精准的基因组编辑。
这项最新研究也提示我们,RNA引导的DNA切割机制存在于所有生物界。

张锋教授表示,基于CRISPR的基因编辑系统功能强大,已经被广泛使用,这是因为它们可以很容易被重新编程以靶向基因组中的不同位点。而这项研究发现的新系统代表了对人类细胞进行精确改变的另一种方式,是对我们已经拥有的基因组编辑工具的补充。
张锋实验室的一个主要目标是利用能够靶向特定基因和过程来调控人类细胞的系统来开发基因药物。张锋教授表示,几年前我们开始思考,除了CRISPR,还有什么?自然界中还有其他RNA可编程系统吗?
2021年9月,张锋团队在 Science 期刊发表论文【2】,发现了一类广泛的转座子编码的RNA引导核酸酶,并将其命名为OMEGA系统(包括IscB、IsrB、Tnp8),而它是CRISPR-Cas系统的祖先。

OMEGA系统使用RNA来指导切割DNA双链,即ωRNA。这些核酸酶很小,仅为Cas9的大约30%,这意味着它们可能更容易被递送到细胞中。这些发现也提示了我们,还有更多的可编程核酸酶等待着发现和进一步开发。
Fanzor是一种由转座子编码的真核TnpB-IS200/IS605样蛋白,来自真核生物的Fanzor蛋白与来自原核生物的Tnp8具有远程同源性。这表明,Fanzor也可能使用RNA引导机制来靶向和切割DNA。
在这项最新研究中,研究团队从真菌、藻类、变形虫以及北圆蛤(一种蛤蜊)中分离Fanzor蛋白,并进行RNA引导系统得研究。对Fanzor蛋白的生化表征表明,Fanzor是一类DNA切割内切酶,使用ωRNA来靶向基因组中的特定位点。这是首次在包括动物在内的真核生物中发现这种机制。
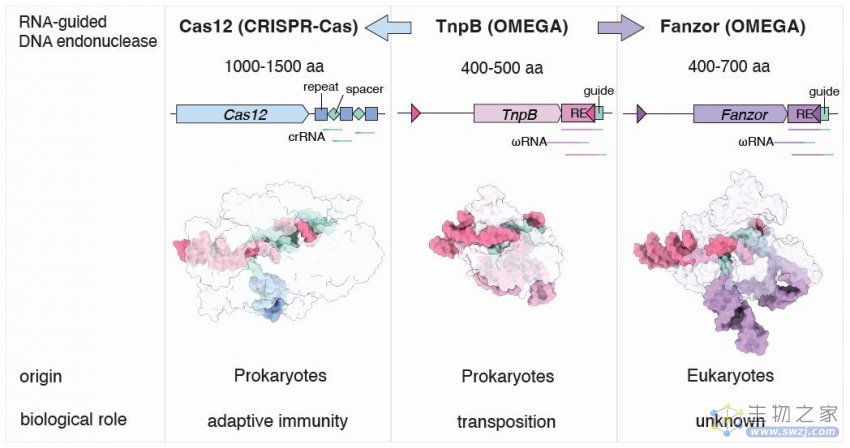
CRISPR-Cas12、TnpB和Fanzor的对比
与CRISPR系统的核酸酶不同的是,Fanzor酶被编码在真核生物基因组的转座子中,系统发育分析表明,Fanzor基因是通过水平基因转移从细菌跳跃到了真核生物中。
为了探索Fanzor作为基因组编辑工具的潜力,研究团队证明了它可以在人类细胞的目标基因组位点上产生DNA插入和缺失。他们发现,Fanzor系统最初在剪切DNA方面的效率低于CRISPR-Cas系统,但通过系统工程改造,在Fanzor蛋白中引入了一系列突变,可使其活性提高10倍。
此外,与一些CRISPR系统和OMEGA系统中的TnpB不同,研究团队发现,真菌来源的Fanzor蛋白没有表现出旁系切隔活性(Collateral Activity),也就是说,Fanzor不会在RNA引导下切割目标位点附近的DNA,这意味着,Fanzor可能实现比CRISPR-Cas系统更精准的基因组编辑。
研究团队还分析了Fanzor-ωRNA复合物的分子结构,并解析了它是如何附着在DNA上并切割DNA的。Fanzor与其在原核生物中对应的CRISPR-Cas12蛋白结构相似,但ωRNA与Fanzor催化结构域的相互作用更为广泛,提示ωRNA可能在催化反应中发挥作用。这些发现有助于进一步设计和优化Fanzor,以提高其作为基因组编辑器的效率和精度。
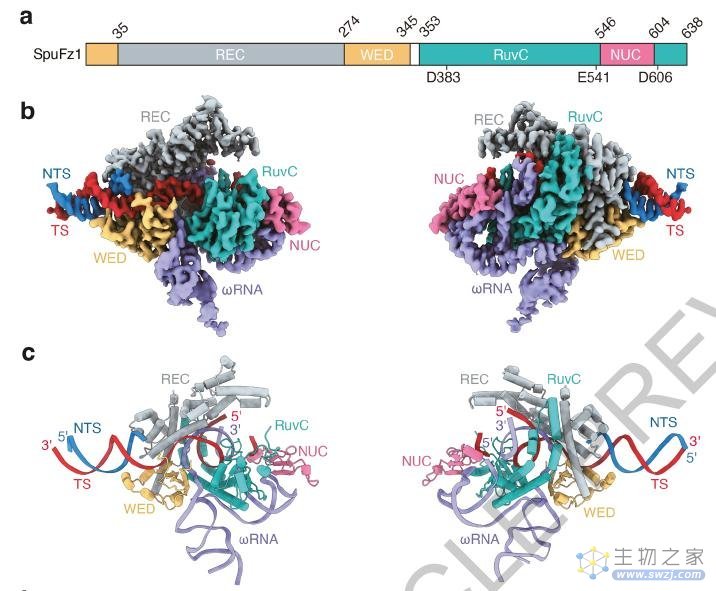
Fanzor蛋白与ωRNA复合物及其靶DNA的冷冻电镜结构,Fanzor蛋白不同结构域用灰色、黄色、浅蓝色和粉红色表示,ωRNA为紫色,DNA双线中的目标链为红色,非目标链为蓝色
就像基于CRISPR的基因编辑系统一样,Fanzor系统可以很容易地进行重编程,从而靶向特定的基因组位点。
张锋教授表示,有一天Fanzor系统可能会发展成为一种强大的新型基因组编辑技术,用于科学研究和疾病治疗。像Fanzors这样的RNA引导的内切酶的发现进一步扩大了已知的OMEGA系统的数量。大自然太神奇了,有着如此丰富的多样性,可能还有很多RNA可编程系统,我们也将继续探索,希望能够发现更多。
论文链接:
1. https://www.science.org/doi/10.1126/science.abj6856
2. https://www.nature.com/articles/s41586-023-06356-2































