2023年6月28日,美国纪念斯隆-凯特琳癌症中心李明教授团队(张晛为第一作者)在 Nature 期刊发表了题为:Reprogramming tumour-associated macrophages to outcompete cancer cells 的研究论文。
该研究通过深入探究饮食调节、免疫系统和癌细胞竞争之间的关系,全面揭示了免疫细胞在癌细胞竞争中的重要调控作用,让我们对肿瘤发展和免疫治疗有了全新理解。

人体的各项功能是由不同细胞间的高度合作实现的,但如果将细胞群体看作一个微型社会,这种精诚合作背后其实也存在着竞争关系。细胞竞争是一种普遍存在于生物体内的现象,它对维持组织稳态、生物发育和疾病发展都具有重要的影响。这种竞争可以控制细胞的质量,消除不够成熟的细胞,让更健康强壮的细胞存活。
这套竞争体系不仅对健康细胞适用,癌细胞也同样有着竞争关系。转录因子MYC经常会在肿瘤内高度表达,然而强中自有强中手,MYC的表达越高,就会在细胞竞争过程中被视为"赢家"状态。
通过使用MYC驱动的乳腺癌模型(MYC-PyMT),研究团队观察到MYC高表达的癌细胞(MYChi)与MYC低表达的凋亡癌细胞(MYClo)紧密相邻,而且MYChi细胞表现出较高的代谢功能和mTORC1活性。当敲除mTORC1复合体中的Raptor蛋白后,MYChi癌细胞的凋亡会增加,肿瘤生长减缓。这些发现揭示了mTORC1在MYC介导的癌细胞竞争中的作用。
作为一个重要的代谢因子,mTORC1活化受营养信号的调控。正是这一联系,让研究人员想到是否能利用饮食来改变MYC/mTORC1介导的癌细胞竞争关系。
根据他们的实验结果,与对照组肿瘤细胞相比,MYC-PyMT肿瘤的生长过程对蛋白质限制饮食更为敏感。低蛋白饮食导致MYC-PyMT小鼠癌细胞的mTORC1信号减弱。意想不到的是,在这一过程中,另一个角色出现了——在执行低蛋白饮食后,肿瘤相关巨噬细胞(TAM)的mTORC1信号得到了显著增强。
进一步的研究发现,在低蛋白饮食处理的MYC-PyMT小鼠中,TAM特异地活化了TFEB/TFE3这个调节细胞吞噬作用的转录因子家族。在敲除了巨噬细胞的TFEB/TFE3蛋白后,研究人员观察到,在低蛋白饮食下,MYC-PyMT肿瘤中TAM的mTORC1信号被抑制,TAM的数量减少,而这一操作却反过来使癌细胞的mTORC1信号得到了增强。
这些发现揭示了一条清晰的肿瘤调控路线,低蛋白饮食通过TFEB/TFE3 对TAM的mTORC1信号调节进行重编程,这样能进一步抑制癌细胞mTORC1的活化和MYC-PyMT小鼠肿瘤的生长。
此外,作者发现Rag GTP酶对TFEB/TFE3的功能发挥很重要,其主要与GTP酶激活蛋白GATOR1和FLCN相关。如果在TAM中敲除了GATOR1,即使是低蛋白饮食,TAM的TFEB/TFE3和mTORC1 的信号通路也无法被激活,肿瘤会加速生长。而反过来,如果敲除了FLCN,即使是正常饮食,TAM仍然可以激活mTORC1信号,抑制肿瘤生长。
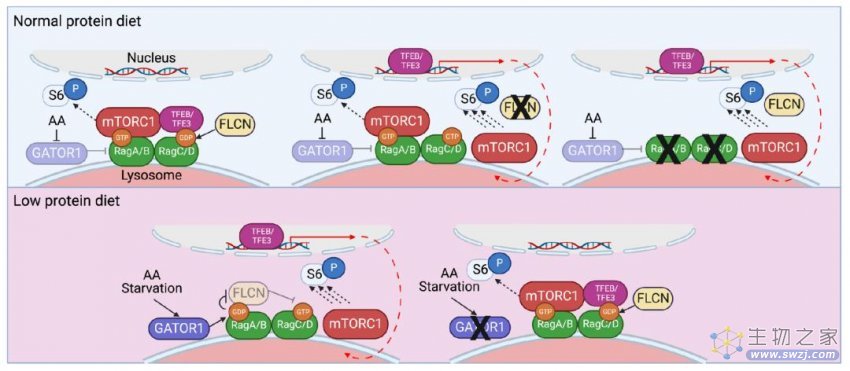
实际上,TAM正是通过吞噬凋亡癌细胞来激活mTORC1信号,从而与癌细胞竞争营养获取并抑制肿瘤生长。研究人员观察到,低蛋白饮食处理的MYC-PyMT肿瘤中的TAM表现出更高的凋亡细胞吞噬活性,并且在较低氨基酸水平的细胞培养基中表现出更高的吞噬活性。
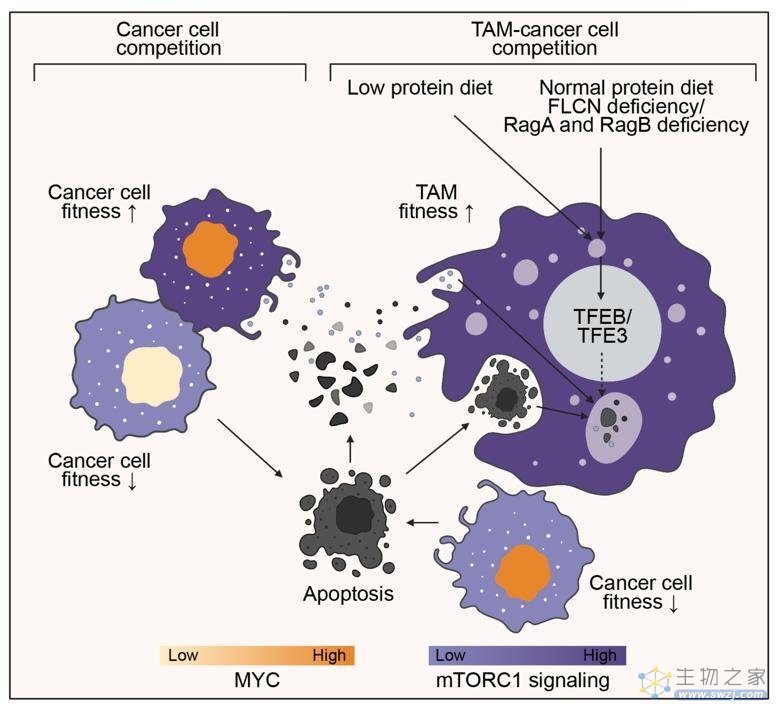
通过对这种细胞竞争关系的控制,科学家们将来有望将其应用为激发体内肿瘤免疫抑制的新策略,成为治疗癌症的有力靶点。
论文链接:
https://www.nature.com/articles/s41586-023-06256-5































