1953 年,人类首次发现 DNA 的双螺旋结构,更为清晰地认识到遗传信息构成和传递途径,让遗传研究深入到分子层面,由此揭开分子生物学新篇章。
人类基因组的 60 亿碱基对如何折叠进仅 10 微米的细胞核内?基因的折叠如何控制其表达以及影响疾病发展?复杂的生物功能是如何从基因组的物理特性和化学成分中产生?人类细胞如何发育出高度特化的功能以及随年龄增长而退化?
为了探索这些问题,斯坦福大学神经生物学系助理教授谭隆志聚焦在一种全新分子机制的研究 —— 三维基因组结构。读博期间,他便开发出了多种单细胞基因组学方法及算法:通过开发的 Dip-C 首次解出人类基因组的三维结构;共同开发 LIANTI 并首次实现全基因组线性扩增、观测 DNA 复制和紫外线突变;共同开发 META-CS 并首次准确揭示单个人类体细胞中的突变……
凭借对解析三维基因组结构新技术的开发以及取得的新发现,谭隆志成为 2022 年度 《麻省理工科技评论》“35 岁以下科技创新 35 人” 中国入选者之一。

▲图|2022 年度《麻省理工科技评论》“35 岁以下科技创新 35 人”中国入选者谭隆志
谭隆志于 2008 年进入北京大学,而后赴麻省理工学院物理系就读,并于 2012 年获得物理学位/生物辅修。2018 年,他获得哈佛大学系统生物学博士学位,随后进入斯坦福大学从事博士后研究。2022年 12 月,谭隆志开始在斯坦福大学神经生物学系担任助理教授。
01
开发 Dip-C 并首次解析出人类基因组三维结构
谭隆志是生物物理学出身,拥有 13 年的跨学科研究经历。“在麻省理工学院读本科时,我就对生物进化过程中 DNA 序列和功能之间的关系产生了兴趣,并首次在实验上证明基因组距离越远,进化就越不可逆。”他介绍说。
2003 年 4 月,“人类基因组计划”完成了人基因组常染色体的大规模测序工作。“人类基因组计划成功解析出了基因组的一维线性序列,而这一DNA 序列有着独特的空间结构。”谭隆志指出,“从 19 世纪 80 年代开始科学界一直想要解析基因组的三维结构,但受限于技术,这个科学难题始终悬而未决。”
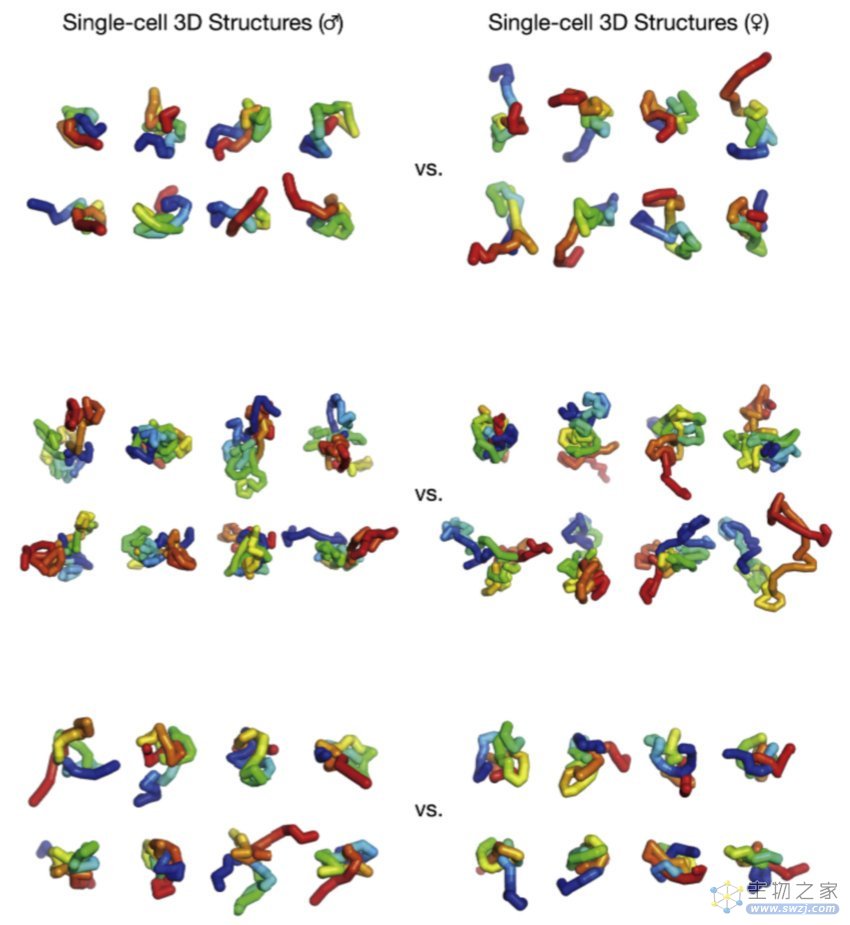
▲图|大脑细胞中关键基因的高清三维结构(来源:Cell)
以人类为例,细胞中的 46 条染色体平分为两套,每套中的 23 条染色体分别来源于父母,且两套染色体序列高度相似,差异小于 0.1%,采用先前的技术难以进行区分。“其实我们起初并不是为了专门开发新技术,而是想要解决一些生物领域难题,解题过程中自然而然需要打破壁垒去开发新的技术。”他说道。
围绕嗅觉系统,他们发现三维基因组结构对于研究嗅觉系统发育至关重要,而传统方法无法解析三维结构,所以他们从零开始着手开发一个具有更高灵敏度的新技术,能够测量出每个细胞中只有数皮克的 DNA,同时也开发新的算法,能够区分来自父母的两套 23 条染色体。
“结合实验手段和分析技术,最终我们开发出了二倍体染色质构象捕获技术(diploid chromatin conformation capture,Dip-C)。”谭隆志说道,“借助 Dip-C 技术,我们首次解析出了人类基因组的三维结构,并且在小鼠的各种组织里解析出了各异的三维基因组结构。除此之外,在人类血液中,通过 Dip-C 技术解析出三维基因组结构还能够推断细胞的功能,比如分辨 B 细胞与 T 细胞,即通过三维基因组结构还可以对细胞进行分型,这是一个前所未有的新发现。”他指出。
▲图|探索正在发育的小鼠大脑皮层和海马体细胞的转录组及三维基因组结构(来源:Cell)
对于 Dip-C 的技术优势,谭隆志总结了三个方面:“首先,Dip-C 通过测量单细胞来解析三维基因组结构,揭示每个细胞独一无二的特性;其次,它完全基于生化反应实现了约 100 纳米的高分辨率,而无需借助光学显微镜等特殊昂贵的大型设备,并且生化反应效率较高,能够确保全基因组大部分 DNA 都能检测到;第三,解析速度较快,一天可以完成数百个乃至上千个细胞,同时解析操作容易上手,成本低廉,易于推广。”他介绍道。
谈及解析三维基因组结构的意义,在谭隆志看来,“人类有两万多个基因编码蛋白质,这些基因在细胞中并不是简简单单一条直线,而是具有很复杂的空间结构。利用我们发现的人类三维基因组的基本原理,可以通过精准三维操纵基因组和治疗性 DNA 载体、激活特定细胞类型,来设计基于三维基因组学的新一代复杂精神疾病的新疗法,对于精准医疗具有重要意义。此外,我们还计划将开发的多基因组学工具广泛应用于大脑之外的生物医学领域,比如癌症生物学和免疫学。”他说道。
02
成立实验室计划构建“三维基因组版 AlphaFold”
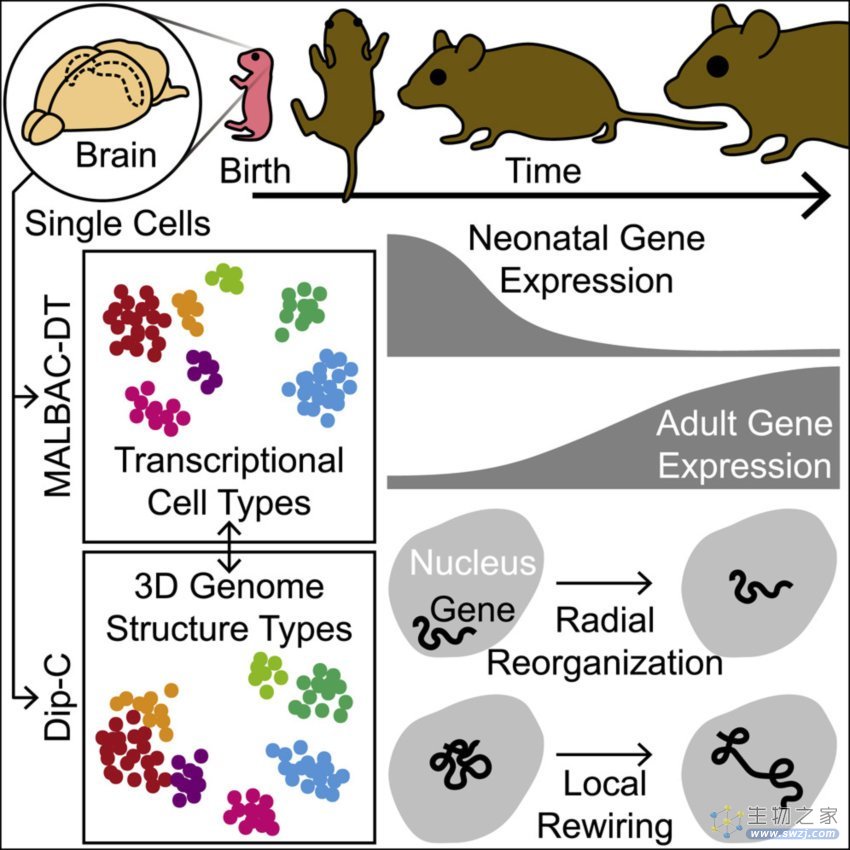
2022 年 12 月,谭隆志在斯坦福大学建立了独立实验室,专注于开发跨越基因组学、神经科学、生物化学和计算机科学领域的新一代单细胞多组学工具,并通过这些工具测量和操控大脑中的单细胞三维基因组结构。
“未来我们还将继续开发新的方法和技术,同时利用这些新技术来探究大脑的变化,相信我们的研究将解开三维基因组调控的‘黑匣子’之谜,并提供广泛适用于各种生物医学领域的新工具。”谭隆志说道。
在他看来,“目前 Dip-C 主要用来解析基因组三维结构,但它也是一种更能广泛应用的新范式,作为一种‘生化显微镜’通过生化反应和生物信息学来倒推出 DNA 结构,这种方式突破了光学分辨率的限制且效果优于传统光学显微镜。此外,Dip-C 技术还可以推广到蛋白、RNA 等其他分子的三维结构解析,未来我们希望能够把 Dip-C 技术从基因组学推广到其他组学。”他表示。
比如,未来或许可以通过将大脑组织浸入特制的反应液中,再进行测序,然后从获得的数据中即可反推出大脑每个细胞、蛋白、DNA、RNA 等在三维空间的位置以及它们相互之间的关联。“借助 Dip-C 这种‘生化显微镜’,我们可以研究在发育和退行性疾病中患者大脑的差异所在,探索不同疾病的多组学变化,进而指导开发基于基因组以及多组学的创新疗法。”他说道。
现阶段,谭隆志实验室开始关注小脑方面的研究。“小脑虽然只占整个大脑约 10% 的体积,但是却包含了约 80% 的神经元细胞,然而围绕小脑基因组方面,业内先前的相关研究并不多。”他表示,“我们发现不论是人还是小鼠,从出生到衰老的过程中,小脑基因组的三维结构都有着翻天覆地的变化,而且包括自闭症、精神分裂症、唐氏综合症,以及阿尔茨海默病等很多疾病都与小脑存在关联。”
“我们的研究对象以脑细胞为主,同时我们也非常期待能够和其他实验室合作,将 Dip-C 技术拓展到更多细胞类型。”谭隆志说道。据介绍,曾有实验室利用他们开发的算法首次解析出了早期胚胎的单细胞结构;还有实验室采用 Dip-C 技术解析肿瘤细胞的三维基因组结构。“肿瘤细胞的基因组,不但三维结构不同,一维序列也不同,因此我们未来的研究方向之一是开发新的算法探索三维结构和一维序列联合导致细胞癌变的机制。”他表示。

产业化层面,在谭隆志看来,对于三维基因组结构的研究具有广阔的应用转化前景。“除了我们聚焦的大脑神经元细胞,所有细胞都有三维基因组结构,因此这对于其他包括免疫、肿瘤等不同生物学领域都有价值。”他说道,“其实很多疾病与三维基因组结构密切相关,但现阶段缺乏能够测量和操控三维基因组的技术工具,我们未来开发的技术希望能够在三维空间中精准地恢复基因组的正常结构,以此来治疗相关疾病。”
据介绍,以自闭症为例,目前已知的约 100 个自闭症相关基因中有一半涉及基因组结构和基因表达,他们通过研究人类基因组在正常发育过程中如何进行三维重组,以及这一过程在疾病中又如何被破坏,有望带来利用表观基因组作为生物标志物的早期诊断方法,以及利用精确三维操控表观基因组的创新疗法。
围绕基因疗法开发,“我们希望设计出用于治疗的 DNA 使其只在特定的细胞中才能折叠出正确结构,产生需要表达的蛋白,如此一来将会使基因疗法变得更精准,更有效,这也是我们在转化方面的研究方向之一。”他表示,“我们的跨学科研究将有助于构建“三维基因组版 AlphaFold”,从而更好地理解和设计人类基因组,开发新疗法,他也坚信,研究基因组的生物物理学将为人类带来对基础生物学和疾病治疗的前所未有的见解。”
值得一提的是,谭隆志目前正计划每年夏季在国内开设一个暑期学校。“目的是让来自全世界各地的学生能够学会如何测量三维基因组结构,希望通过这一举措能让更多人学会这项全新的技术,掌握这种前沿的试验方法。”他说道。
参考资料:
1.https://doi.org/10.1016/j.cell.2020.12.032
2.https://www.science.org/doi/10.1126/science.aat5641
3.https://doi.org/10.1038/s41594-019-0205-2































