宿主细胞依赖多种免疫应答机制来对抗病毒感染。其中,针对核酸分子的免疫识别和操作是核心的抗病毒免疫策略,广泛存在于从细菌到哺乳动物等几乎所有宿主系统(图1)。相较于哺乳动物细胞稍显复杂的信号转导和调控,细菌往往更为简单高效,其编码的多种抗病毒免疫系统可直接对核酸分子进行切割或修饰(图1)。这种特点使得细菌免疫系统被广泛用于多种生物学工具的开发(如R-M和CRISPR-Cas等),促进整个生命医学领域的发展。
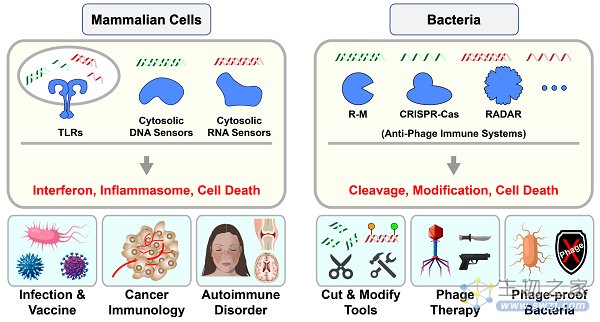
图1.针对核酸分子的免疫识别和操作
近期,张锋和Eugene Koonin团队鉴定出拥有全新核酸修饰活性的细菌免疫系统——RADAR(phage restriction by an adenosine deaminase acting on RNA)。RADAR是目前已知唯一可通过催化RNA的A-to-I(adenosine-to-inosine)脱氨来执行抗病毒功能的细菌防御系统,包含两种核心组分即RdrA(ATPase酶活性)和RdrB(腺苷脱氨酶活性),且这两种酶活性对于RADAR执行功能都是必须的。病毒感染后,RADAR被激活并广泛催化宿主及病毒的转录组RNA脱氨,造成被感染细胞的死亡,进而阻断病毒传播。RADAR在抗病毒免疫和RNA修饰方面展现出多种新颖特点,且有潜力被开发为新型的生物学工具,因此受到领域内的广泛关注。当前,关于RADAR的研究仅是冰山一角,还有较多核心科学问题亟待回答。
2023年2月9日,中国科学院生物物理研究所高璞团队在 Cell 期刊发表了题为:Molecular basis of RADAR anti-phage supramolecular assemblies 的研究论文。
该研究发现了RADAR不同组分间的互作关系,揭示了其通过形成新型超分子复合体来实现RNA装载、运输和脱氨修饰的精妙偶联机制,拓展了科学家对细菌-病毒博弈复杂性的认知,并为开发基于RADAR的多种生物学工具提供了思路。

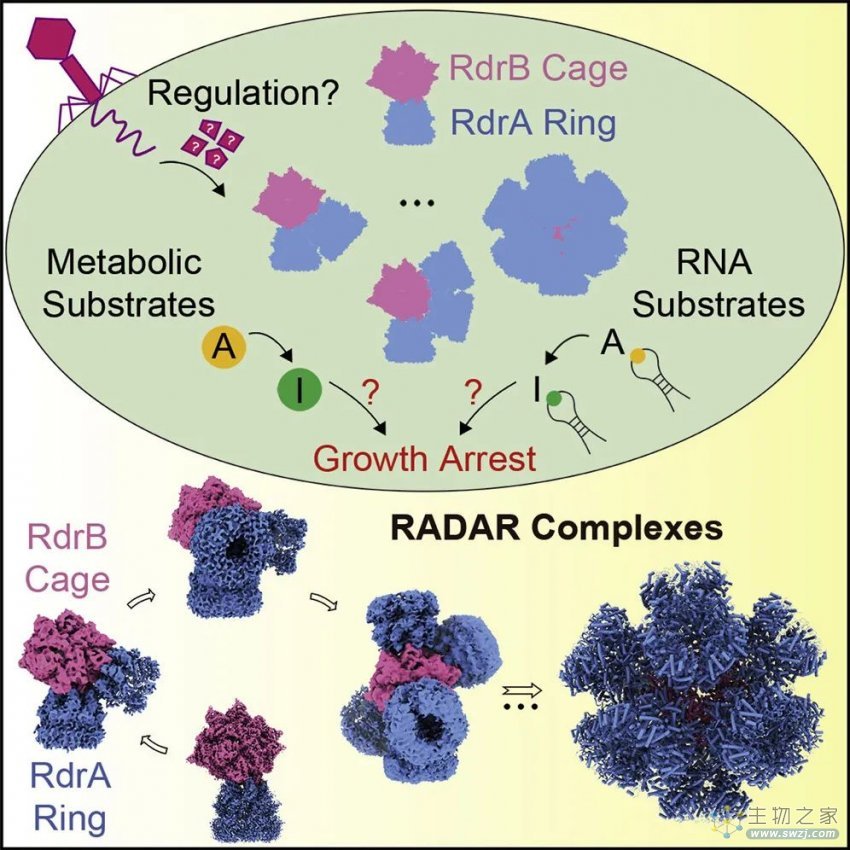
此前已知能催化RNA A-to-I 脱氨的酶只有ADAR和ADAT两类,从进化上均属CDA超家族。而RADAR中的脱氨酶组分RdrB,在进化上却属于差别巨大的ADA超家族。RdrB的大小近3倍于经典ADA成员,除催化结构域外还存在多个作用未知的插入区域。为更好地剖析RdrB的功能,研究人员解析了RdrB的高分辨率冷冻电镜结构,发现了12个RdrB按照特定方式组装成一个闭合的笼状结构(~1.1MDa)。该笼状结构拥有典型的正六面体排列,这在ADA和CDA超家族中均未被报道。这种精巧的组装依赖于催化结构域和多个插入区域的协同作用。进一步的功能实验表明,RdrB亚基间的互作对抗病毒功能至关重要。所有RdrB的催化口袋都朝向笼子的外侧,暗示其随时准备识别和催化临近的底物。
研究通过结构分析和生化验证发现,RdrB并不能有效结合含Stem-Loop元件的底物RNA。那么,对RADAR功能同样关键的另一个组分RdrA,是否会协助RdrB对RNA的修饰?科研人员解析了RdrA的结构发现,RdrA同时组装成单层的7聚体环(~0.75 MDa)和由两个7聚体环叠合而成的双层14聚体环(~1.5 MDa)。每个7聚体环都呈现为顶部结构稳定、而底部结构动态多变的特点,提示这两个区域潜在的不同功能。更重要的是,RdrA环中心形成了一个独特的通道,其直径和表面电荷均符合底物RNA的特点,提示该通道可能用于底物运输。后续生化实验表明,RdrA环与Stem-Loop RNA存在特异性结合,且RNA的存在可显著促进RdrA的ATPase酶活性。接下来,研究人员解析了RdrA与Stem-Loop RNA复合物的结构,捕捉到RNA装载到RdrA环的动态底部的构象。同时,研究发现RNA的装载与ATP的结合存在联动关系,提示RdrA可通过控制ATP水解来发挥其底物的装载和运输功能。
基于上述工作,科研人员基本确定了RdrA负责底物装载和运输,而RdrB负责底物脱氨的功能分工,但不清楚两者如何实现酶活偶联。研究人员通过生化实验确定了RdrA和RdrB之间存在直接互作,并进一步通过结构解析阐明了两者互作的分子细节。RdrA的7聚体环通过其结构稳定的顶部与RdrB笼进行对接,且RdrA环的底物运输通道恰好与RdrB的活性中心对齐,从而实现了底物装载、运输和修饰的巧妙偶联。结构分析还表明,1-12个RdrA 7聚体环可以通过动态的方式与RdrB笼对接。完整组装的RADAR复合体包含96个蛋白亚基,颗粒直径40 nm,仅蛋白部分的分子量达10.1 MDa。
除了RNA类底物,研究还发现RdrB及RdrA-RdrB复合物也可以催化多种小分子代谢类底物(ATP/dATP/ADP/dADP/AMP/dAMP/adenosine)的脱氨反应。近期有工作表明,细胞内的小分子类inosine大量聚集,也会对细胞产生毒性并使其生长停滞。因此,RADAR对RNA类底物和小分子类底物的脱氨修饰,可能共同推动了其有效的抗病毒功能。
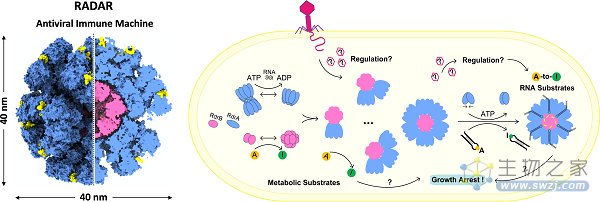
图2.RADAR超分子复合体的组装和工作机制
综上,该研究报道了RADAR系统复杂且新颖的超分子复合体组装细节,发现了RADAR实现底物装载、运输及修饰的多酶偶联机制,并为开发基于RADAR的碱基编辑(base-editing)工具、纳米颗粒载体和新型抗菌疗法等奠定了基础。
中科院生物物理所高艺娜副研究员为论文第一作者,高璞研究员为论文通讯作者。研究工作得到国家自然科学基金、科技部、北京市自然科学基金、中科院等的支持。冷冻电镜数据收集和样品分析等工作得到生物物理所成像中心和质谱平台的帮助。
论文链接:
https://doi.org/10.1016/j.cell.2023.01.026































