胶质母细胞瘤(GBM)是侵袭性脑肿瘤,尽管已经采取多模式治疗,但中位总生存期仅为12-15个月。GBM在很大程度上对免疫疗法具有抗性,原因可能在于肿瘤免疫原性差、高度免疫抑制的微环境和GBM相关血管系统功能障碍。淋巴细胞因子是促进癌症促炎反应的有吸引力的候选因子,能协调高内皮微静脉 (HEV) 和三级淋巴结构 (TLSs) 的发育,其中,HEV由专门的内皮细胞组成,可促进淋巴器官中的淋巴细胞外渗,它们在肿瘤中的存在与免疫细胞浸润增加和免疫治疗反应改善有关,而TLSs是已在各种类型的癌症中观察到的异位淋巴结构,通常与积极的预后相关【1, 2】,但导致癌症中TLSs新生的机制尚未完全阐明。
2023年5月11日,来自瑞典乌普萨拉大学的Anna Dimberg团队在Cancer Cell杂志上发表了文章 Tailoring vascular phenotype through AAV therapy promotes anti-tumor immunity in glioma ,他们预先筛选了一组与淋巴细胞生成相关的分子,从中选择LIGHT作为治疗GBM最有希望的候选靶点,采用脑内皮细胞特异性腺相关病毒载体在胶质瘤小鼠的肿瘤脉管系统中表达LIGHT(AAV-LIGHT) ,可诱导肿瘤相关的HEV和TLSs,从而延长αPD-1耐药的GBM小鼠的生存期。这些发现表明通过血管靶向表达LIGHT改变血管表型可促进有效的抗肿瘤T细胞反应并延长胶质瘤的生存期,这对于治疗其他免疫疗法耐药的癌症具有更广泛的意义。

为了探究参与淋巴组织发育的因素是否会促进胶质瘤中TLS的发育和抗肿瘤免疫反应,作者分别在鼠胶质瘤细胞CT-2A中过表达CXCL13、CCL21、LTαβ或LIGHT分子并进行体外生长测定,随后将携带上述基因的CT-2A分别注射至小鼠体内并监测小鼠存活率,其中,LTαβ或LIGHT的过表达促进了小鼠存活并在靠近肿瘤的脑膜区域内诱导了富含T细胞的TLS (T-TLS) ,对植入各种CT-2A的小鼠大脑进行染色发现过表达LTab或LIGHT的胶质瘤具有显著增加的、具有典型HEV特征的血管比例。基于这些发现,作者进一步设计了专门针对脑内皮细胞的AAV载体表达LIGHT以测试其在αPD-1治疗抗性的CT-2A神经胶质瘤模型和mGC1模型中的功效,结果显示用AAV-LIGHT治疗荷瘤小鼠可延长生存期并诱导T-TLS和TA-HEV。其中,T-TLS以T细胞、CD11c+DC和CCL21+FRC(成纤维网状细胞)样细胞为主,类似于淋巴结的T细胞区。
为了确定AAV-LIGHT疗法是否通过促进抗肿瘤免疫反应来限制神经胶质瘤的进展,作者在表达卵清蛋白的CT-2A细胞植入后分离CD45+肿瘤浸润免疫细胞并进行了靶向scRNA-seq和流式分析。无监督聚类分析确定了五种CD8+T细胞亚型,AAV-LIGHT治疗后>50%的肿瘤浸润性CD8+T细胞处于Tstem样状态,在第14天,对治疗有反应(无肉眼可见肿瘤)的小鼠大脑中CD8+T细胞主要处于效应状态,随后转变为记忆状态,相当少的部分处于Texhausted状态,AAV-GFP对照组恰恰相反,提示LIGHT疗法介导的肿瘤消退与肿瘤特异性CD8+T细胞强烈的细胞毒性和记忆反应的诱导相关。
接下来,作者使用LTβR-IgG作为诱饵来中和LTβR配体并评估这将如何影响AAV-LIGHT治疗后TLS、HEV和Tstem样细胞的诱导。LTβR-IgG给药完全消除了AAV-LIGHT提供的生存益处,显著减少了TLS和HEV,以及肿瘤中CD8+T细胞和Tstem样细胞的比例。有趣的是,与在LIGHY过表达肿瘤中观察到的情况相反,LTβR配体LTα和LTβ的过表达不足以增加CT-2A胶质瘤中的Tstem样细胞,这些数据证实了LTβR/HVEM信号轴在AAV-LIGHT疗效中的重要性。
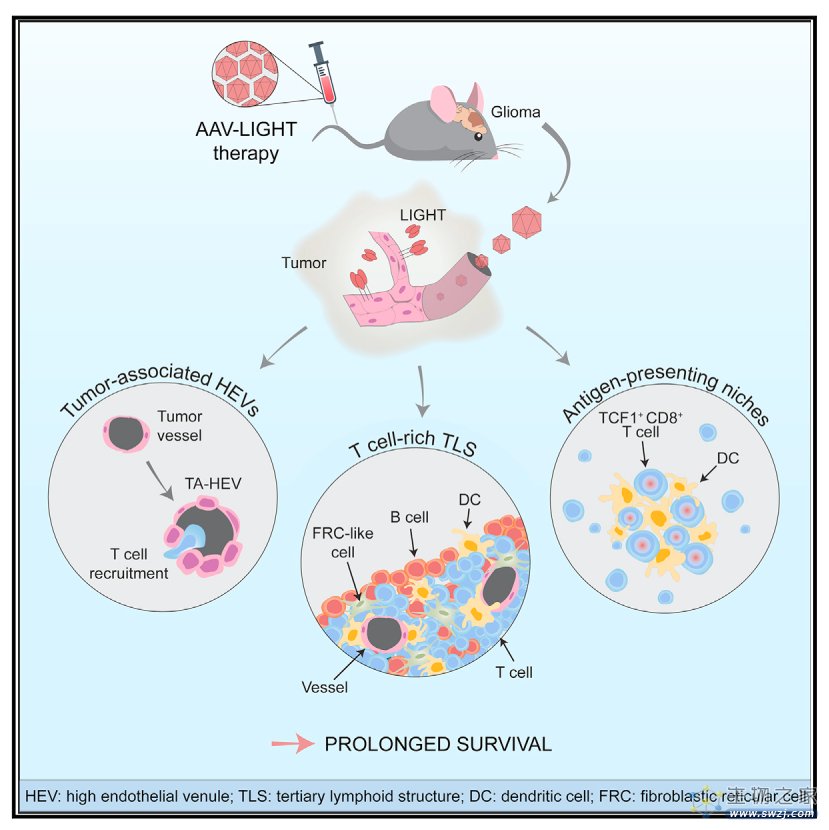
总之,这项数据表明利用AAV-LIGHT可以作为对免疫检查点阻断疗法无反应的GBM的一种潜在治疗选择,可以通过AAV介导的血管基因表达定制血管表型可用于促进抗肿瘤免疫反应,这对GBM的其他免疫治疗耐药癌症具有重要意义。
原文链接:https://doi.org/10.1016/j.ccell.2023.04.010
参考文献
1. Asrir, A., Tardiveau, C., Coudert, J., Laffont, R., Blanchard, L., Bellard, E., Veerman, K., Bettini, S., Lafouresse, F., Vina, E., et al. (2022). Tumor-associated high endothelial venules mediate lymphocyte entry into tumors and predict response to PD-1 plus CTLA-4 combination immunotherapy. Cancer Cell 40, 318–334.e9. https://doi.org/10.1016/j.ccell.2022.01.002.
2. Dieu-Nosjean, M.C., Giraldo, N.A., Kaplon, H., Germain, C., Fridman, W.H., and Saute` s-Fridman, C. (2016). Tertiary lymphoid structures, drivers of the anti-tumor responses in human cancers. Immunol. Rev. 271, 260–275. https://doi.org/10.1111/imr.12405.































