将癌细胞转化为癌症疫苗,消灭癌细胞,防止复发? 治疗性肿瘤细胞(ThTC)有望成为一类新的抗癌药物
癌症疫苗一直是一个热门研究方向。治疗性肿瘤细胞(ThTC)有望成为一类新的抗癌制剂,因为它们天然携带肿瘤新抗原,可以触发免疫细胞向肿瘤部位的有效运输,从而在不同类型的癌症中诱导抗肿瘤免疫反应。目前,已有多项针对非小细胞肺癌、结直肠癌、黑素瘤等癌症的灭活肿瘤细胞的临床试验——灭活肿瘤细胞可以诱导有效的抗肿瘤免疫反应,但这种方法在诱导免疫反应之前不能杀死肿瘤细胞,因此效果有限。
活肿瘤细胞具有独特的定位和肿瘤靶向潜力。因此,通过工程肿瘤细胞表达有治疗效果的分子,同时利用它们的天然肿瘤抗原来源——可能是一种合理的思路。在各种用于癌症治疗的药物中,干扰素β (IFN-β)因其同时具有直接(抑制肿瘤细胞增殖和血管生成)和间接(激活抗肿瘤免疫反应)作用而备受关注。然而,工程肿瘤细胞稳定分泌IFN-β不仅会杀死肿瘤细胞,而且会自我杀伤。
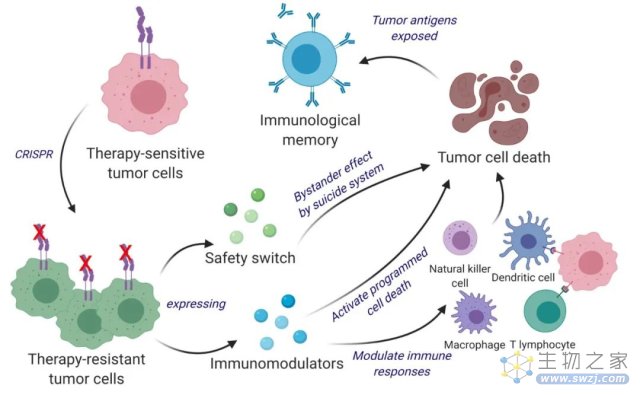
基于这些考虑,哈佛医学院的研究人员Chen等人通过CRISPR编辑敲除IFN-β受体从而使工程活肿瘤细胞对IFN-β不敏感,进而改造使之分泌干扰素β (IFNB)和粒细胞-巨噬细胞集落刺激因子(GM-CSF)来靶向肿瘤并改变肿瘤微环境,这些工程治疗肿瘤细胞(ThTCs)在晚期致命的脑肿瘤——胶质母细胞瘤人源化小鼠中成功消除了肿瘤,使得生存率和长期免疫力提高。这些基因工程的肿瘤细胞不仅可以杀死肿瘤细胞,而且很容易被免疫系统发现、标记和记忆,从而达到抗癌和防止复发的双重功能。此外,Chen等人采用了双杀伤开关来防止继发性肿瘤启动,提供了一种将癌细胞转化为有效的抗癌疫苗的有效和安全的治疗方法,值得进一步研究。文章于2023年初发表在《科学》杂志的子刊《科学转化医学》上,题为《双功能癌细胞疫苗同时驱动直接杀伤肿瘤和抗肿瘤免疫》。
他们先使用CRISPR-Cas9敲除干扰素-β特异性受体,使对干扰素-β (IFN-β)敏感的肿瘤细胞变为不敏感,随后对其进行改造,释放免疫调节剂IFN-β和粒细胞-巨噬细胞集落刺激因子(GM-CSF)。GM-CSF的表达促进树突状细胞的抗原交叉呈递、共刺激分子的表达和促炎细胞因子的产生,从而为免疫系统的长期抗肿瘤反应做好准备。
在胶质母细胞瘤肿瘤小鼠模型中,这些工程治疗肿瘤细胞(ThTCs)通过诱导Caspase介导的癌细胞凋亡、下调癌症相关的成纤维细胞表达的血小板衍生生长因子受体β、激活抗肿瘤免疫细胞运输和抗原特异性T细胞激活信号,成功消除了小鼠体内已建立的胶质母细胞瘤肿瘤。研究团队还在多种原发性、复发性和转移性小鼠癌症模型,以及在人源化小鼠模型中(包括来自人类的骨髓、肝脏和胸腺细胞模拟人类免疫微环境)中测试了治疗性肿瘤细胞(ThTC)的疗效,结果表明治疗性肿瘤细胞(ThTC)可以赋予生存益处并建立长期免疫。
值得留意的是,由于这种癌症疫苗使用活的肿瘤细胞,为了确保安全性,研究小组在治疗性肿瘤细胞(ThTC)中加入由单纯疱疹病毒1型胸苷激酶(HSV-TK)和雷帕霉素激活的Caspase9组成的双杀伤的安全开关,激活后可根除这些治疗性肿瘤细胞,从而确保了方法的安全性。用双功能疗法武装天然新抗原丰富的肿瘤细胞代表了一种有希望的实体肿瘤细胞免疫疗法,实验表明这种基于全癌细胞的双功能治疗方法,具有直接杀死肿瘤和免疫刺激的作用。研究人员建立了临床转化的路线图。
该论文通讯作者Khalid Shah教授表示,研究团队一直在追求一个简单的想法:将癌细胞转化为癌症杀手和疫苗,采用一种创新和可转化的方法来开发的这种治疗性抗癌疫苗策略适用于更广泛的实体瘤,值得进一步探索,最终将对医学产生持久的影响。
参考文献
Bifunctional cancer cell–based vaccine concomitantly drives direct tumor killing and antitumor immunity































