背景
真核生物的基因表达需要成熟的mRNAs从细胞核选择性转运到细胞质进行翻译。在细胞核中,mRNAs被帽化、剪接、剪切、多腺苷酸化,并与各种蛋白质结合形成mRNPs。这些剪接的mRNPs在mRNA 5 '端包含帽结合复合物 (CBC),外显子连接复合物 (EJC)在每个剪接连接的上游和poly (A)结合蛋白在mRNA 3 '端。然后,mRNPs被保守的必需TREX识别,这需要其DExD-box ATP酶亚基UAP56 (在酵母中为Sub2)和mRNA输出适配器ALYREF (在酵母中为Yra1)。TREX随后授权将mRNA输出因子NXF1-NXT1加载到这些mRNPs上,从而使其能够核输出。在这一过程中,TREX将mRNAs与其未成熟的前体和其他核RNAs区分开来。此外,TREX可以阻止RNA-DNA杂交的形成,从而保护基因组的完整性。TREX如何选择性识别并随后作用于mRNPs尚不清楚。
简介

2023年4月5日,来自奥地利维也纳生物中心 (VBC)分子病理学研究所 (IMP)的Belén Pacheco-Fiallos及其团队在Nature (IF: 69.504)杂志上发表名为mRNA recognition and packaging by the human transcription-export complex的研究[1]。
主要结果
ALYREF-EJC结构
在结构中,6个拷贝的ALYREF (55-182) -EJC-RNA (原聚体1-6)通过多价和保守的ALYREF-EJC相互作用连接形成一个环。每个原聚体提供一个EJC-EJC和三个ALYREF-EJC接口,我们将其标记为a、b、c和d,并描述原聚体1 (图1b,c)。在原聚体1的EJC亚基EIF4A3 N端和原聚体2的亚基Y14之间形成EJC - EJC界面 (图1b,左)。原聚体接口b包含了与自身复合体EIF4A3结合的ALYREF WxHD元素 (原聚体1) (图1b,c)。接口c和d涉及ALYREF RRM相对两侧的两个表面。RRM一边与原聚体2的MAGOH结合 (界面c),另一边通过扩展的ALYREF环和一个保守的残基R144 (我们称之为R-finger)插入原聚体3的EIF4A3-MAGOH腔 (界面d)。这三个ALYREF - EJC接口 (b, c和d)揭示了ALYREF如何特异性识别剪接的mRNPs并促进EJC多聚化。为了支持这一结构,ALYREF WxHD (界面b)或RRM结构域 (界面c和d)的突变损害了ALYREF - EJC - RNA复合物的体外形成和ALYREF - EJC - RNA的多聚化。此外,突变的ALYREF WxHD或RRM结构域减少了核提取物中ALYREF - mRNP的结合。总之,这些数据表明,多价ALYREF-EJC相互作用有助于特异性mRNP识别。
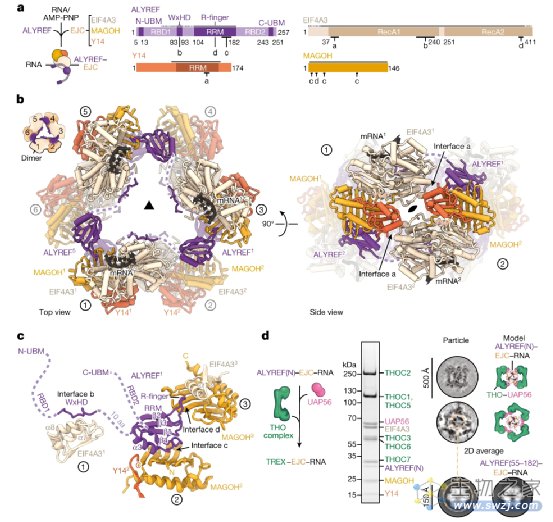
图1. 一种ALYREF-EJC低聚物的结构
内源性TREX-mRNPs的冷冻电镜
我们的重组TREX–EJC–RNA数据提出了mRNP识别和TREX组装的模型,但内源性mRNP如何在三维中组织,以及它们如何参与完整的TREX复合体仍不清楚。为了回答这些问题,我们从人类细胞中纯化了内源性TREX-mRNP复合物,并通过冷冻-EM和蛋白质交联分析了这些复合物。我们在人K562细胞中过表达GFP标记的TREX亚基THOC1,并从核提取物中分离出TREX - mRNPs。TREX - mRNPs沉积在90S附近,包含TREX复合体的所有亚单位、EJC和mRNPs的其他成分,如CBC、CHTOP、ERH和SRSF1 (图2a)。这一结果与之前纯化的人类TREX和剪接的mRNPs一致。TREX-mRNPs含有磷酸化的SRSF1 (核内mRNPs的标志),但缺乏mRNA输出因子NXF1-NXT1。我们通过另外两种纯化策略获得了相同的TREX-mRNP蛋白组成:不同的核提取物制备程序和CRISPR–Cas9介导的K562细胞中THO亚基THOC5的GFP敲入。这些结果支持我们方法的稳健性。对纯化的TREX-mRNPs进行mRNA 3'端测序发现,人类mRNA具有多样性,这与iCLIP数据中与ALYREF结合的人mRNA具有多样性相一致。综上所述,我们能够在mRNA输出因子加载前分离出内源性mRNPs与完整的TREX复合物结合。
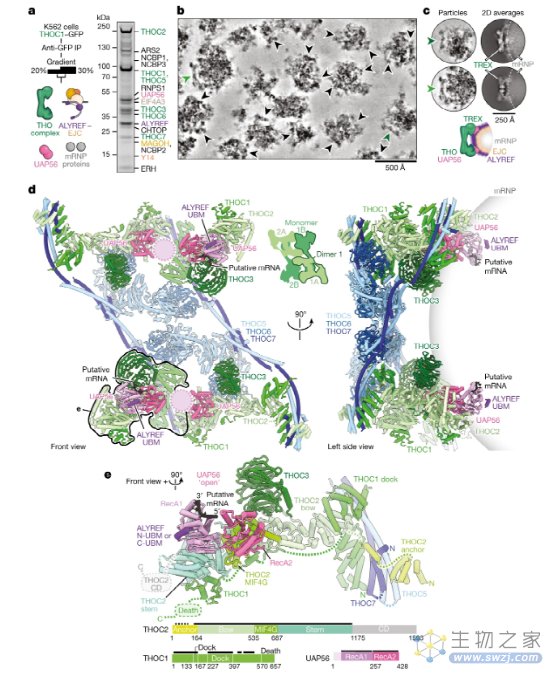
图2. 内源性TREX-mRNP复合物的结构
TREX复合物覆盖在mRNP表面
TREX复合物仅在mRNP表面结合,并与mRNP的四个UAP56亚基结合 (图4a,b)。多个TREX复合物可能通过TREX - TREX相互作用与mRNP结合,如重组TREX核心THO-UAP56复合物所观察到的那样。为了评估这种可能性,我们确定了275对TREX复合体,由TREX- A和TREX-B组成,并在TREX- A上对其进行了比对。对于每一对,我们确定了TREX-A与TREX-B的相对方向和距离,并在真实空间 (图4c)或降维 (t-分布式随机邻域嵌入 (t-SNE))中绘制这些方向和距离 (图4d)。两种方法均显示TREX对随机取样mRNP表面。与这一发现一致的是,只有1 / 5的TREX对发生了TREX- A和TREX-B相互作用,这提示,对于多个复合物结合一个mRNP而言,TREX- TREX接触并不是必需的。不同的TREX-mRNP结构也与酵母或人类mRNAs中缺乏序列特异性或位置特异性TREX结合位点相一致。我们的综合分析表明,TREX复合体相互独立地与mRNP相关,这可能是TREX适应mRNP形状和大小多样性所需要的。
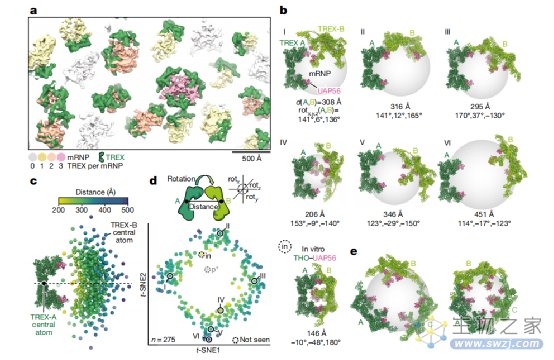
图4. TREX-mRNP复合物的结构
结论及展望
新合成的mRNAs被加工和包装成成熟的核糖核蛋白复合物 (mRNPs),并被必需转录输出复合物 (TREX)识别,用于核输出。然而,mRNP识别和三维组织的机制尚不清楚。在这里,我们报告了与2-MDa TREX复合物结合的重组和内源性人mRNPs的低温电子显微镜和断层扫描结构。我们发现,mRNPs是通过TREX亚基ALYREF和mRNPs结合外显子连接复合物之间的多价相互作用被识别。外显子连接复合体可以通过ALYREF多聚化,这提示了mRNP的组织机制。内源性mRNPs形成被多个TREX复合物包裹的致密小球。这些结果揭示了TREX如何同时识别、压缩和保护mRNAs,以促进其核出口包装。mRNP小球的组织为理解mRNP结构如何促进mRNA的生物发生和输出提供了一个框架。
原文链接:https://www.nature.com/articles/s41586-023-05904-0
参考文献
1.Pacheco-Fiallos Belén,Vorländer Matthias K,Riabov-Bassat Daria et al. mRNA recognition and packaging by the human transcription-export complex.[J] .Nature, 2023, undefined: undefined.































