
人一生中,约有三分之一的时间在睡眠中度过。睡眠的重要性不言而喻,但随着社会飞速发展以及生活节奏加快,“拼命十三郎”们只能舍弃睡眠时间,转而投入996甚至007的“社畜”工作中。
除了繁忙的工作压缩了睡眠时间外,一个更常见的现象是「报复性熬夜」——白天被各种琐事儿缠身,只有当晚上躺在床上的那一刻,时间才开始属于自己,接着就是“无止境”的熬夜。
据《中国睡眠研究报告2023》最新公布的数据,2022年中国人的入睡时间集中在23点至1点,比2021年向后推迟了1小时。此外,一项针对中国职场青年的报告显示,超五成职场青年每天在12点之后才睡觉,甚至有13%的要熬到凌晨2点后。
不过,正如大家调侃得那样“晚上不睡,白天崩溃”。崩溃的不仅是精神,还有身体的方方面面!早在2007年,国际癌症研究机构(IARC)就把熬夜(包括昼夜节律打乱的轮班工作)定义为2A类致癌物。除此之外,熬夜还会导致主要心血管不良事件的风险增加92%;增加海马体中抑制神经元活动,破坏记忆巩固;甚至于死亡!
(详情可见:熬夜不仅使人变傻,心梗面积还更大!JACC:熬夜导致心脏不良事件显著增加92%!)
来自哈佛医学院的研究团队发现了熬夜致死的关键机制——熬夜致死的原因不在于大脑,而在于肠道。具体来说,睡眠不足能导致活性氧(ROS)在果蝇和小鼠肠道内积累,进而诱发氧化应激,最终引起机体的死亡。该研究发表在Cell上。

DOI:https://doi.org/10.1016/j.cell.2020.04.049
生命离不开睡眠,而睡眠又由神经元产生。一直以来,科学界认为,睡眠剥夺导致死亡的原因是大脑功能受损,此后的一系列研究也发现“熬夜后会出现明显的认知下降”,从而佐证了这一观点。
然而,除了认知损害之外,睡眠不足还会导致胃肠道、免疫、代谢、循环等多系统功能障碍。那么,这些变化到底是睡眠剥夺的直接独立影响,还是神经系统功能改变后的次要产物?到底是哪一类的损伤导致了动物的过早死亡呢?
果蝇实验首次证明:
严重的睡眠不足会导致ROS增加
诱发氧化应激,引起过早死亡
为了回答上述问题,研究者首先在与人类共享许多睡眠调节基因的果蝇上进行了一系列实验。通过对果蝇的神经元进行致热刺激(当温度从21°C上升至29°C时,果蝇体内的热敏蛋白TrpA1处于激活状态,从而刺激神经元,剥夺果蝇的睡眠),果蝇失去了90%的睡眠。
与对照组相比,睡眠剥夺后果蝇会更早地死亡。具体来说,果蝇在睡眠不足的10天后死亡率明显飙升,并在第20天左右全部死亡;但相比之下,对照组在相同的环境条件下最多可存活约40天。此外,更大程度的睡眠剥夺,也会导致个体果蝇的死亡时间提前。
不过,睡眠剥夺的负面影响具有可逆性。研究人员发现,在连续10天的熬夜之后,果蝇的死亡率明显升高;但如果在第10天让果蝇恢复睡眠,存活下来的个体又会重新建立正常的睡眠-觉醒周期,且寿命能恢复到对照组的基线水平。
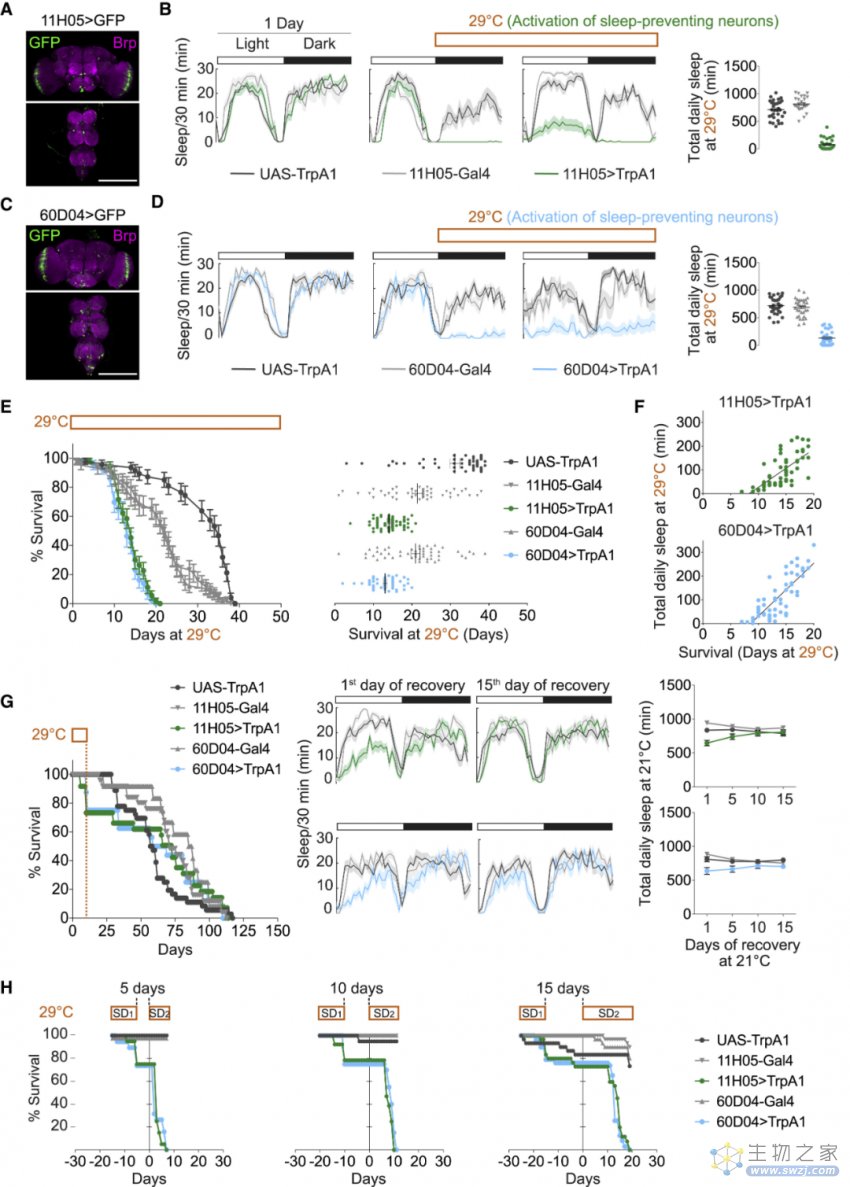
睡眠剥夺缩短了果蝇的寿命
过早死亡是最终的结果,那么成因到底是什么?
对比了实验组和对照组的全身细胞损伤的各种标志物后,研究者终于发现了两组之间的主要区别:睡眠不足的果蝇肠道中ROS水平明显增加。
事实上,ROS的积累是渐进性的,在连续10天的睡眠不足后飙升至顶峰。但在果蝇恢复睡眠后,ROS水平也会逐渐下降,15天后会恢复至基线水平(但会比基线略高一些)。
高水平ROS的危害在于,能通过氧化作用破坏细胞大分子,广泛地损伤肠道中DNA;此外,氧化还引发了适应性途径,导致应激颗粒和溶酶体的数量增加。在持续的氧化下,肠道中的细胞出现了凋亡和坏死。
研究者表示,所有的氧化应激标志物均出现于ROS开始积累之后,这说明细胞损伤和死亡是ROS增加所致的结果,而非原因。当果蝇重新恢复睡眠之后,肠道内ROS的水平逐渐恢复至基线水平,氧化应激标志物也随之降低。
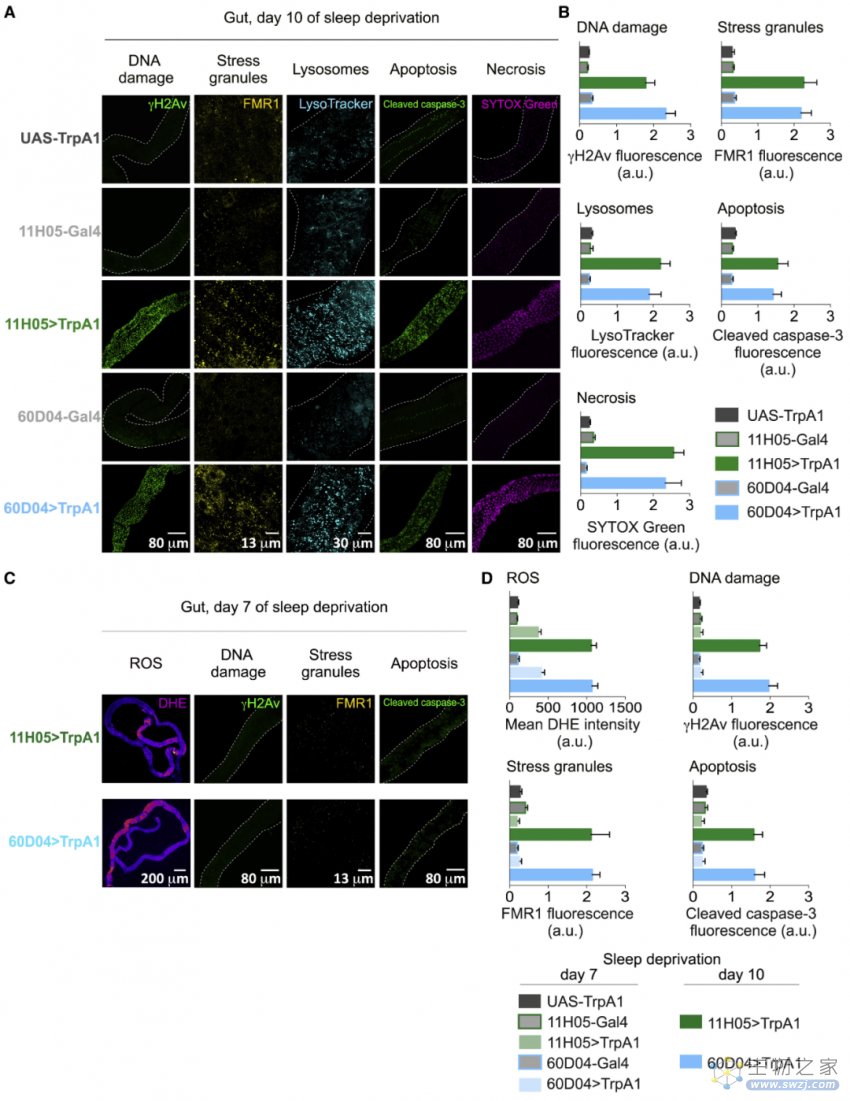
睡眠剥夺会导致肠道氧化应激的发生
小鼠实验再次确认:
睡眠不足导致哺乳动物肠道中
ROS的积累和氧化应激的发生
研究者进一步在小鼠实验中测试了该发现的可推广性。果不其然,小鼠体内也观察到了类似的现象:与正常休息的对照组相比,睡眠不足的小鼠体内ROS水平明显更高,尤其是在小肠和大肠中,而大脑和肝脏中的ROS水平则没有显著上升。
在剥夺小鼠睡眠的2天后,小肠内ROS水平明显增加;5天之后,能够在小鼠小肠和大肠中明显检测到DNA损伤、应激颗粒以及细胞死亡标志物。
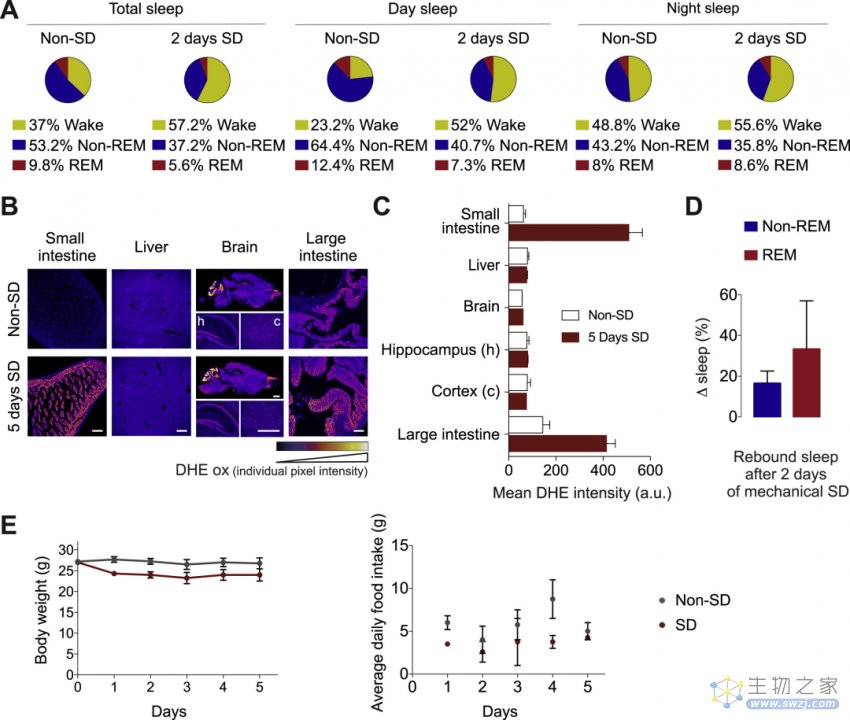
小鼠睡眠剥夺导致大肠和小肠内ROS积累
既然ROS是导致氧化应激以及细胞死亡的“罪魁祸首”,那中和ROS能否在不增加睡眠的情况下延长生存期呢(岂不是能成为“永动机”)?
研究者使用具有抗氧化特性的化合物,促进了内源性抗氧化酶的表达或者直接中和实验动物体内的ROS。结果显示,在不增加睡眠的情况下,果蝇和小鼠的存活率依然得到了提高。
此外,研究人员还靶向肠道过表达了抗氧化酶。结果表明,肠道中抗氧化酶的过表达同样能够清除ROS积累,使睡眠不足的果蝇具有了正常或接近正常的寿命;然而,在神经系统中过表达过氧化酶的则没有类似效果。
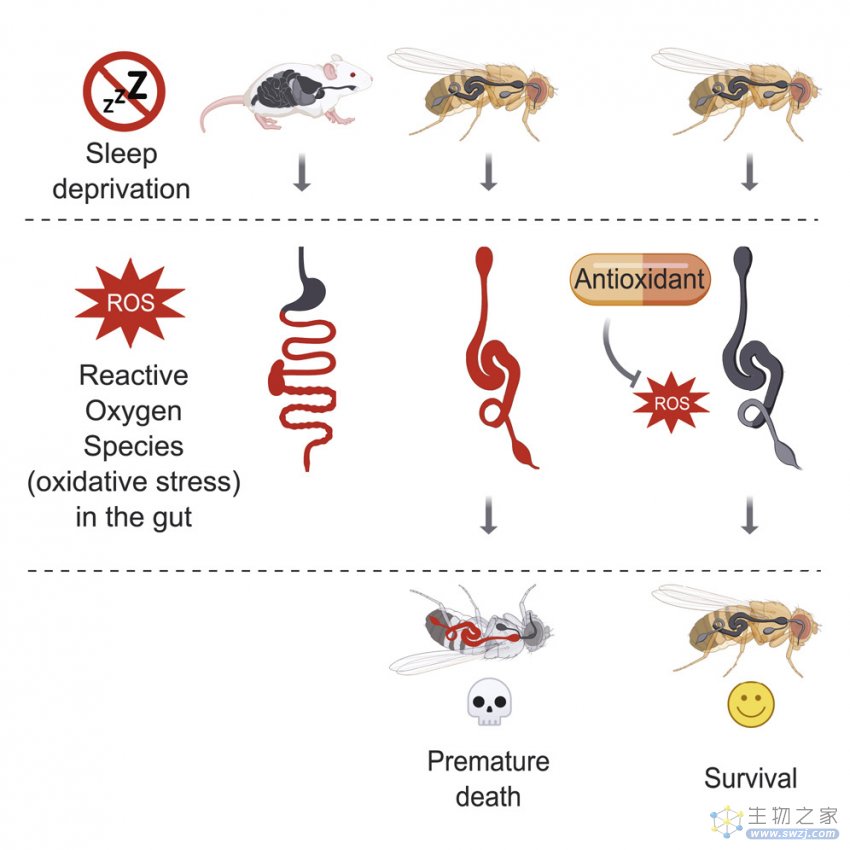
实验流程图
事实上,约90%的ROS在线粒体氧依赖性ATP合成过程中产生。在正常睡眠的静息状态下,新陈代谢减少,氧化还原反应的速率降低,抑制了ROS的产生;但睡眠不足的情况下,新陈代谢显著增加,ROS自然也会随之升高。而肠道在进化的早期便已出现,可能对新陈代谢扰乱具有特殊的敏感性。
此外,ROS的另一个潜在来源是内质网,作为蛋白质氧化折叠的副产物。当内质网应激出现时,即折叠错误或者未折叠的蛋白质积累后,蛋白质需求的增加会导致更多的ROS产生,从而引发氧化应激;同时,ER应激还会诱导线粒体产生更多的ROS。在经常熬夜的情况下,可能会直接或间接地诱发肠道中的ER应激。
综上,严重的睡眠不足会使肠道中的ROS持续累积并诱发氧化应激,进而导致机体的死亡;但通过对ROS的中和能够防止氧化应激,即使没有恢复睡眠,依然能够拥有正常的寿命。
敖夜的伤害也不用小编重申了吧,好好睡觉才是真正的“续命”~在有机会的情况下,去睡个好觉吧!
参考资料:doi: 10.1016/j.cell.2020.04.049.































