当地时间12月19日,Atara Biotherapeutics和Pierre Fabre共同宣布,欧盟委员会(EC)已授予Ebvallo (tabelecleucel)的上市许可,作为一种单一疗法,用于治疗既往接受过至少1种治疗的复发性或难治性EB病毒(EBV)相关的移植后淋巴组织增生性疾病(EBV+PTLD)成人和2岁以上儿童患者。对于实体器官移植患者,先前的治疗包括化疗,除非化疗不合适。新闻稿指出,这是全球首个获批的同种异体T细胞免疫疗法。

Ebvallo (tabelecleucel)是一款同种异体T细胞免疫疗法,以人类白细胞抗原(HLA)限定的方式靶向并消除EBV感染的细胞。它曾获FDA的突破性疗法认定和EMA授予的PRIME资格。
EBV+PTLD是一种罕见的、急性的、潜在致命的血液系统恶性肿瘤,发生在移植后,当患者的T细胞免疫反应受到免疫抑制的损害时。它可能影响接受实体器官移植(SOT)或同种异体造血细胞移植(HCT)的患者。据报告,标准治疗失败的EBV+PTLD患者的HCT和SOT中位生存期较差,分别为0.7个月和4.1个月,这强调了对新的治疗方案的迫切需求。
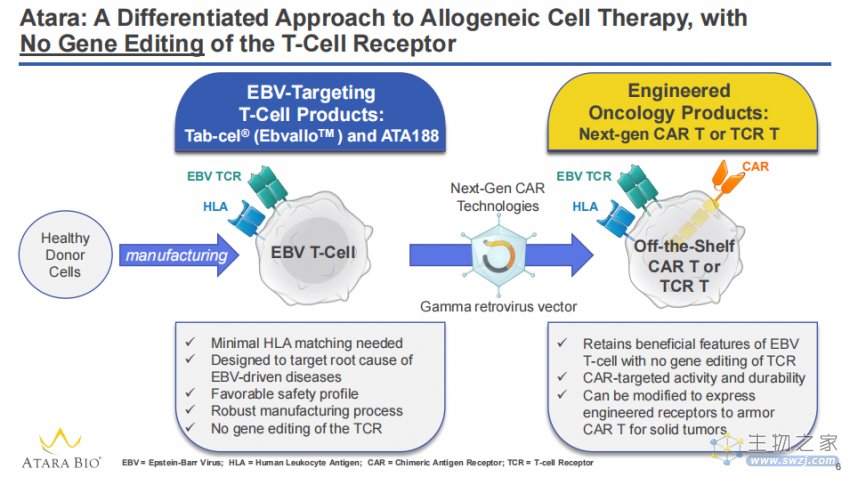
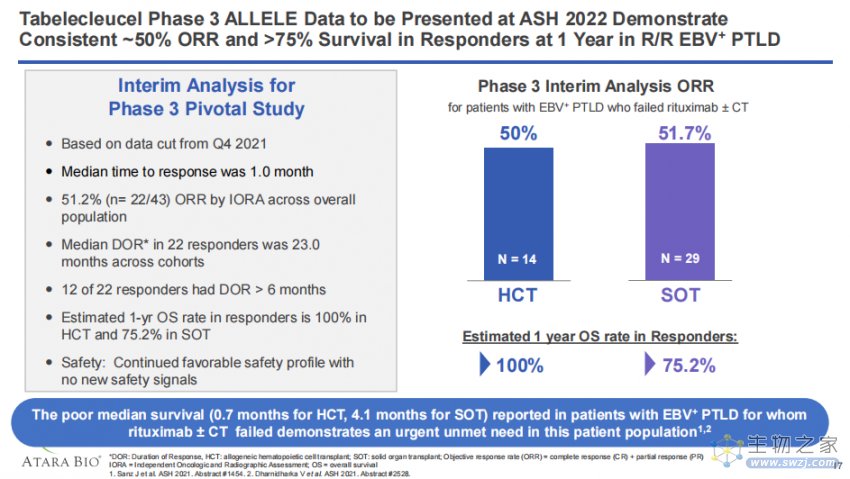
该批准是在欧洲药品管理局(EMA)人用药品委员会(CHMP)于今年10月发表积极意见后批准的,适用于所有27个欧盟成员国以及冰岛、挪威和列支敦士登。CHMP的积极意见是基于关键的3期ALLELE研究的结果。
结果显示,截至2021年11月,在43例可评估患者(29例SOT后,14例HCT后)中观察到的总客观缓解率(ORR)为51.2%(n=22/43),其中完全缓解率(CR)为27.9%。在22例获得缓解的患者中,12例患者的持续缓解时间(DOR)>6个月,中位DOR为23个月。同时,tabelecleucel对治疗有响应的患者生存获益显著(1年OS率:100%vs 75.2%)。
在安全性方面,与之前发表的数据一致,未发生移植物抗宿主病(GvHD)、输注相关反应、细胞因子释放综合征、感染性疾病等不良反应。
“Ebvallo在欧洲的获批,对于有重大未满足需求的患者来说是一项医学突破,”Atara总裁兼首席执行官Pascal Touchon说。“作为全球首个获得任何监管机构批准的同种异体或供体来源的T细胞免疫疗法,这对Atara、我们的欧洲合作伙伴Pierre Fabre以及更广泛的细胞治疗领域来说都是一个历史性的时刻。”































