人类的第一个gasdermin (GSDM)基因可追溯到2000年,此后又发现了另外5个旁系基因。GSDMs最初与多种疾病相关,包括听力损失、哮喘、脱发和癌症;然而,它们的具体生物学功能在过去的十多年中仍然难以捉摸。2015年,三项研究独立描述了GSDMD的成孔能力,报告了其作为细胞焦亡的主要效应因子的功能。“细胞焦亡”一词于2001年首次被引入,用来描述一种依赖于非凋亡型半胱氨酸天冬氨酸蛋白酶-1 (caspase-1)的调节性细胞死亡形式,并促进炎症反应。在过去的几年中,细胞焦亡的定义发生了变化,目前认为细胞质膜内GSDM孔的组装是细胞焦亡的标志性特征。尽管这一定义限制了GSDMs作为细胞焦亡不可或缺的角色,但有报告表明,它们可以促进其他形式的调节性细胞死亡和一些非裂解过程。
简介

2023年2月13日,来自美国凯斯西储大学医学院的Giuseppe Privitera及其团队在Nat Rev Gastroenterol Hepatol (IF: 73.082)杂志上发表名为The gasdermin protein family: emerging roles in gastrointestinal health and disease的研究[1]。
研究亮点
1、gasdermin (GSDM,一种成孔蛋白家族)家族参与多种生物学过程,其5个成员 (GSDMA到GSDME)是影响胃肠道健康和疾病的主要因素。
2、GSDMs主要被称为细胞焦亡的介质;然而,有证据支持其他作用,包括炎症细胞因子的非溶解性释放、重要细胞功能的调控和靶向杀菌作用。
3、每种GSDM对胃肠道健康和疾病的贡献是明确的,尽管不明确,有报告称它们既可促进胃肠道癌症、感染和免疫介导的疾病,也可预防这些疾病。
4、初步证据表明,GSDMs在临床胃肠道实践中具有潜在应用价值,未来的研究需要利用它们作为预测或预后的生物标志物和/或特定的治疗靶点。
5、关于GSDM的焦亡和非焦亡功能和相关信号通路、全长形式的生物活性,以及它们在免疫和非免疫细胞中的作用,目前在GSDM生物学方面存在知识缺口和争议。
主要结果
GSDM生物学的一般概念
人类存在6个旁系基因:GSDMA、GSDMB、GSDMC、GSDMD、常染色体显性耳聋 (DFNA) 5 (也称为GSDME)和常染色体隐性耳聋 (DFNB) 59 (也称为pejvakin (PJVK,一种来自gasdermin家族的过氧化物酶体相关蛋白)),它们在两个高度保守的氨基末端 (NT)和羧基末端结构域上具有45%的同源性。除了最初观察到GSDMD介导免疫细胞中caspase-1依赖性焦亡之外,后续研究揭示了GSDM的许多共同和独特特征,包括它们的细胞来源和/或定位、激活通路和生物学功能 (总结见图1)。
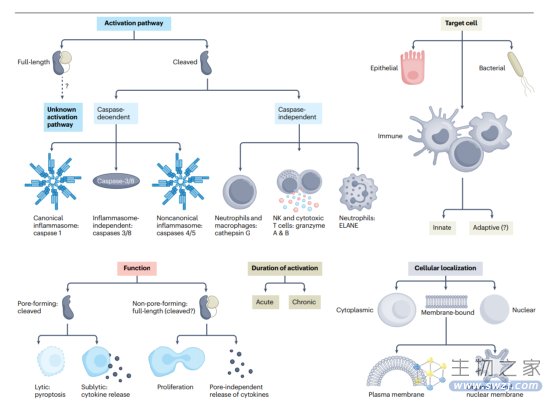
图1. gasdermins的重要特性
GSDMs对胃肠道相关疾病的影响
癌症
在胃肠道相关癌症的背景下,可以尝试将GSDMs的作用分为以下几类:(1)促进肿瘤易感条件,肿瘤的发展和扩散;(2) GSDM依赖性肿瘤细胞死亡;(3)影响肿瘤微环境 (TME)的激活;和(4)作为抗肿瘤治疗的效应物。图2说明了上皮源性的GSDM在胃肠道癌症中的主要作用。
GSDMs促进炎症并影响肿瘤细胞的生物学。由于GSDM毛孔通常会引发局部炎症,因此它们的激活可被认为是肿瘤发展的一般易感因素,因为慢性炎症会增加恶性转化的风险。Tan等人描述了结肠炎相关CRC的小鼠模型,在该模型中,以GSDME依赖的方式产生和释放的IEC衍生的HMGB1诱导了肿瘤增殖。一项在小鼠模型中进行的研究表明,GSDMs在控制肿瘤细胞增殖方面具有更直接的作用。具体来说,在Apcflox/flox小鼠中,GSDMC一旦失去TGFβ依赖性抑制,就会诱导CRC中的肿瘤细胞增殖。相反,GSDMD表达下调促进胃癌细胞增殖。此外,在体外观察到GSDMB-FL介导IEC增殖和迁移,提示其可能促进胃肠道癌症的发展,类似于乳腺癌,其中GSDMB的表达与肿瘤的生长和扩散相关。对肿瘤中GSDM基因表达的分析揭示了在CRC中GSDMA,GSDMB,GSDMD和GSDME的差异调控的潜在作用;GSDME可以正向调控细胞迁移和血管生成,而GSDMA,GSDMB和GSDMD则可能下调这些过程。综上所述,这些发现表明,不同细胞功能的GSDM依赖性调控可能在胃肠道恶性肿瘤的发生和发展中起重要作用。
GSDM-孔可导致肿瘤克隆的死亡和/或促进炎症介质的释放。Caspase 3或GZMB可激活GSDME诱导肿瘤细胞焦亡。GSDME在结直肠癌细胞中常被沉默,挽救其表达可以降低肿瘤负荷,提示GSDME是一种癌抑制因子。如上所述,GSDME-孔在结肠炎相关癌症发病机制中的作用似乎与这一概念相矛盾。在其他正常的IECs中,慢性GSDME活性可能是癌变的刺激因素,而肿瘤细胞的突然焦亡可能发挥整体的肿瘤抑制作用。Croes及其同事证明,在偶氮氧甲烷处理的小鼠和Apc1638N/+小鼠中,Gsdme缺失均不影响CRC的发展。在散发性CRC的小鼠模型中,为了使肿瘤逃避免疫监视,肿瘤细胞可能需要GSDME沉默。因此,在Gsdme缺陷小鼠中,对癌变的易感性不会增加,因为即使在野生型小鼠中,Gsdme在其肿瘤中也已经功能性缺失。此外,与癌旁组织相比,食管癌组织中GSDME水平升高,其基因表达与更好的预后相关,这可能取决于caspase 3介导的GSDME裂解,从而诱导细胞焦亡和随后的肿瘤细胞清除。
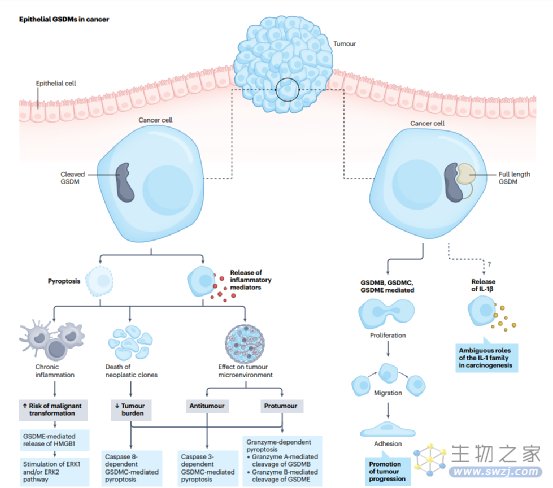
图2. 上皮源性的gasderins在胃肠道癌症中的作用和贡献
肠道感染
有证据表明,GSDMs在对包括沙门氏菌、志贺菌和耶尔森菌在内的食源性病原体做出应答时被激活。图3a显示了肠黏膜源性的GSDMs在应对局部感染时所执行的功能。在这方面,我们需要考虑两个主要问题:(1)在肠道造血细胞相对于上皮细胞中GSDMs的激活,以及(2)它们对细胞外和细胞内病原体的应答。
炎症性肠病
GSDMs作为维持慢性肠道炎症的宿主非稳态应答的关键介质,在IBD领域受到越来越多的关注,如图3b所示。多种单核苷酸多态性 (SNPs)与IBD的遗传易感性相关,主要集中在GSDMB,也包括GSDMA、GSDMD和GSDME。此外,GSDMs参与免疫细胞和上皮细胞的固有反应,并对宿主肠道微生物群产生相互影响。
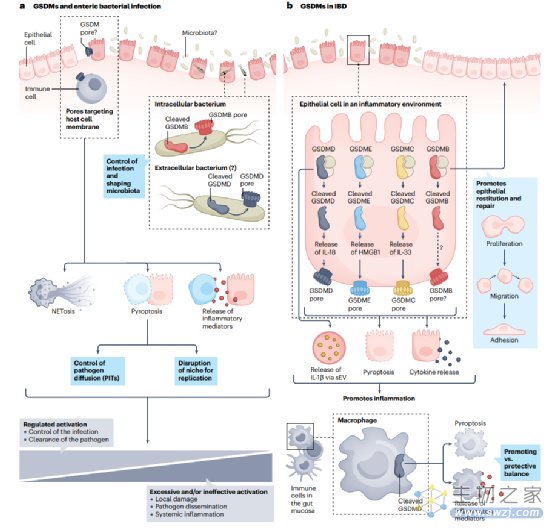
图3. gasdermins在胃肠炎症中的作用和贡献
结论及展望
随着gasdermin (GSDM,一种成孔蛋白家族) D作为炎性调控性细胞死亡 (或细胞焦亡)的主要效应蛋白的鉴定和表征,关于GSDM家族成孔蛋白的文献迅速增多,揭示了除细胞焦亡之外的调控其表达和功能的新机制。事实上,越来越多的证据证实了GSDMs在胃肠道系统中的重要性,强调了它们对胃肠道癌症、肠道感染和肠黏膜炎症 (如炎症性肠病)的病理生理学的重要贡献。然而,随着对GSDM认识的增加,一些关于GSDM基础生物学及其在健康和疾病状态中的作用的重要和有争议的问题出现了。这些问题包括以下关键问题:GSDM依赖性的裂解功能和非裂解功能,裂解蛋白和全长蛋白的生物活性,表达GSDM的黏膜免疫细胞和上皮细胞的不同作用,以及在特定疾病背景下,GSDM是否促进致病作用或保护作用。本综述对目前关于GSDM生物学的文献进行了全面的总结和解读,特别侧重于胃肠道,突出了主要的争议问题及其临床意义,并提出了未来的研究领域,以揭示这一有趣而神秘的蛋白家族的具体作用。
原文链接:https://www.nature.com/articles/s41575-023-00743-w
参考文献:1.Privitera Giuseppe,Rana Nitish,Armuzzi Alessandro et al. The gasdermin protein family: emerging roles in gastrointestinal health and disease.[J] .Nat Rev Gastroenterol Hepatol, 2023, undefined: undefined.































