巨细胞病毒(CMV)是一种疱疹病毒组DNA病毒,亦称细胞包涵体病毒,由于感染后细胞会出现肿大,并具有巨大的核内包涵体,故称之为巨细胞病毒。巨细胞病毒分布广泛,人和其他动物皆可遭受感染。感染人类的CMV称为HCMV,正式名为人疱疹病毒5型(HHV-5)。
虽然HCMV是弱致病因子,对免疫功能正常的人没有明显的致病性,绝大多数都表现为无症状感染,但对于病理性和生理性免疫低下人群如发育性免疫缺陷的胎儿和新生儿来说会造成疾病,也会致使艾滋病病人或者器官/骨髓移植患者发生严重疾病甚至死亡。先天性巨细胞病毒感染不仅会对新生儿的肝脏造成损害,还会引起听力、眼病、牙病等后遗症,尤其对神经系统损害较大。然而,目前并没有针对巨细胞病毒的疫苗。
近日,据一项发表在Cell Reports Methods上的研究报道,来自美国新泽西州立罗格斯大学的科学家们开发出一种阻止巨细胞病毒感染的新方法——DNA复制缺陷型的减毒活疫苗。这种方法使用一种名为centanamycin(CM)的化合物来产生变异病毒,CM能够使病毒DNA发生烷化,烷化可以使 DNA 双链之间形成非常紧密的结合,导致 DNA 无法完成复制、转录和翻译等过程。如此一来,使用CM减毒处理后的病毒就能够在不破坏动物机体健康的前提下,刺激机体产生强大的免疫应答,是一种很有潜力的DNA病毒疫苗生产工艺。
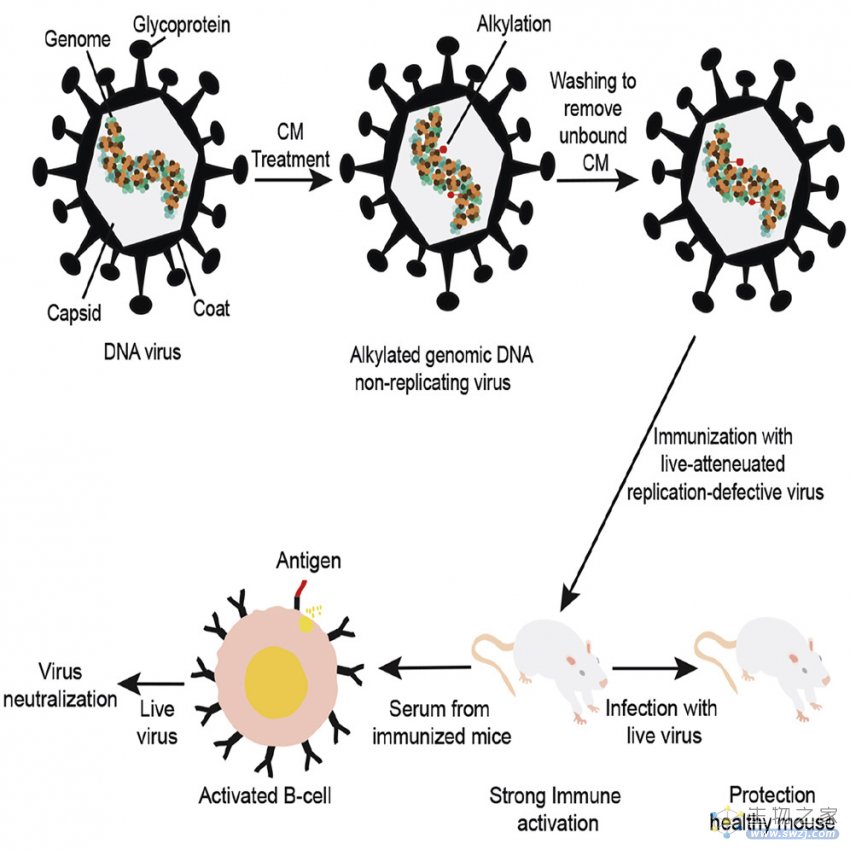
构建CM减毒活病毒
作者首先使用Toledo-Luc测试了CM对HCMV生长的影响,Toledo-Luc是能够稳定表达萤火虫酶荧光的HCMV,已被广泛用于病毒生长曲线分析。先使用不同浓度的CM处理Toledo-Luc,然后让Toledo-Luc去感染MRC-5细胞(人胚肺二倍体成纤维细胞),发现CM浓度在≥1μM时能够使HCMV完全失活,而0.1μM浓度的CM处理后,病毒仍能感染细胞,但无法进一步复制,扩大自己的感染范围。
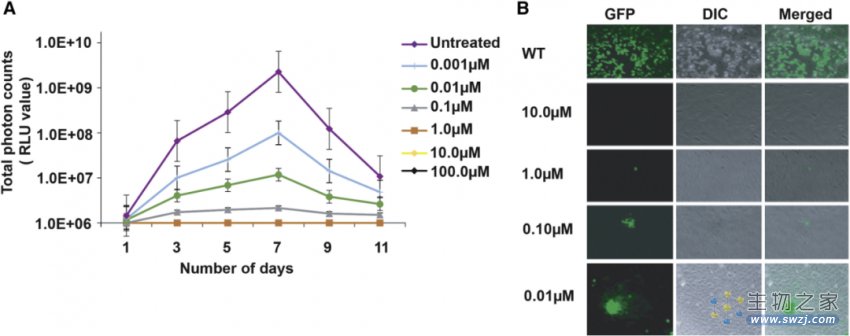
CM通过烷基化抑制病毒DNA复制
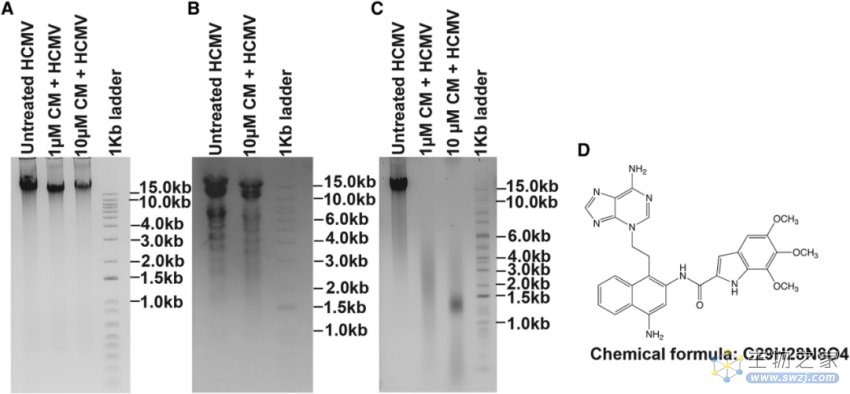
为了了解CM是怎么使得病毒感染能力下降的,作者使用琼脂糖凝胶电泳分析了CM处理的病毒DNA。结果表明,常温条件下,经CM处理和未处理的病毒DNA条带、迁移率并无显著差异。然而,在50℃条件下,与对照相比,CM处理的病毒DNA在凝胶上呈现片段化,说明CM处理的病毒DNA对温度更加敏感。采用液相色谱-质谱联用(LC-MS)法对样品进行分析,发现CM可以使病毒DNA腺嘌呤中的N3发生烷基化,从而在高温条件下产生溶解性的复合物。
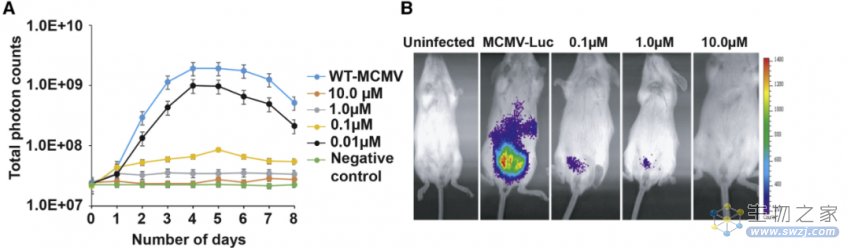
体内实验验证CM减毒活病毒的免疫原性
将CM处理过的MCMV(鼠巨细胞病毒)注射到小鼠体内,结果发现,注射10μM CM处理的MCMV后,小鼠没有出现任何感染,表明病毒完全灭活。有趣的是,注射0.1和1μM CM处理的MCMV后,小鼠出现了体内的病毒感染,但病毒无法在距离感染部位更远的地方复制。在病毒注射10天后获取小鼠的唾液,并利用空斑法检测组织匀浆样本的病毒滴度,结果显示免疫小鼠未显示任何病毒滴度,提示完全保护。
提取免疫小鼠的血清转移到未免疫小鼠,后者也能够防止病毒的攻击,说明免疫小鼠血清中产生了足够的抗体。可以想象,在这种减毒感染期间,小鼠的免疫系统可能有足够的时间将病毒识别为外来抗原,并产生针对该病毒的特异性抗体。因此,CM处理后的MCMV存在复制缺陷,为宿主识别病毒并激活免疫系统提供了机会。
总结与展望
DNA病毒对全球健康和经济构成重大威胁。在这项研究中,科学家们综合评估了CM对病毒毒性的影响,以及将减毒活DNA病毒作为疫苗的潜力。CM能够在抑制病毒复制的同时保留病毒的免疫原性,注射了减毒活病毒的小鼠不会出现器官组织的损害,并且能够在血清中产生足够的抗体,为DNA病毒疫苗的研发提供了非常宝贵的实践经验。































