“遇事不决,量子力学;机制难寻,肠道菌群”是网友们面对许多无法解释的现象都被归结于这两门学科的调侃,不过,这项发表于Immunity的最新研究“The gut microbiota promotes distal tissue regeneration via RORγ+ regulatory T cell emissaries”指出,如果没有肠道中的细菌,肌肉在受伤后可能无法自行再生。在这一过程中,源自结肠的调节性T细胞依赖肠道微生物向受损肌肉积聚,并保护分化的肌肉干细胞免受IL-17影响。

图1 研究成果(图源:[1])
01
Treg细胞在受损肌肉中积聚,将炎症状态转变为抗炎状态
调节性T细胞(Regulatory T cell,Treg)是一群负责抑制其他免疫细胞免疫反应的细胞,对于维持自身耐受、避免过度的免疫反应具有重要作用。“组织Treg细胞”则指的是那些位于淋巴组织之外,如内脏脂肪组织、骨骼肌、皮肤和结肠固有层等位置的Treg细胞,具有独特的转录组和T细胞受体(TCR)库。组织Treg细胞能够与微环境中的各种免疫或非免疫细胞进行动态交流,因此能够发挥多种功能,如调节局部和全身新陈代谢,加强对微生物群的耐受性,调节组织再生以应对损伤等,从而在各种情形下保护组织稳态。
在伤口愈合的情境中,Treg细胞会在受伤后汇聚于受损的肌肉,并在四天后数量达到峰值,组织也在这时由炎症状态转变为抗炎状态。通常认为Treg细胞主导了这种转变,这对于伤口愈合具有关键作用,可减少组织损伤和纤维化。
02
肌肉中表达RORγ的Treg细胞源自结肠
这项研究起始于对Treg细胞在伤口愈合中作用的考察。研究人员使用单细胞RNA测序分析了受损部位的Treg细胞,并确定了几种类型。但有一类Treg细胞格外特别:它表达一种名为RORγ的转录因子,这是结肠中Treg细胞的标志。
研究人员采用多种方法确定这些表达RORγ的Treg细胞究竟来自何处:
首先,研究人员向Treg细胞耗竭的小鼠注入传统CD4+ T细胞(Tconv细胞)和Treg细胞,结果发现在受损肌肉中检测到了少量的Treg细胞,且这些Treg细胞缺乏RORγ的表达,表明Treg细胞并非在再生肌肉中分化为表达RORγ的亚群。
单细胞RNA测序的结果则表明,肌肉和结肠中表达RORγ的Treg细胞其转录谱存在明显的相似性,进一步佐证了肌肉损伤促使结肠RORγ+ Treg细胞向骨骼肌迁移的合理性。
随后,研究人员将来自脾脏和结肠的CD4+ T细胞分别转移到T细胞缺陷的小鼠身上。肌肉损伤3天后,相比移植脾脏来源T细胞的小鼠,在移植结肠来源T细胞的小鼠身上,结肠和肌肉中表达RORγ的亚群所占Treg细胞的比例要大得多。
研究人员还对小鼠进行基因改造,使其全身都表达荧光蛋白Kaede。这种特殊的荧光蛋白能够在特定波段的激光照射下发生不可逆的光转换,荧光颜色由绿色变为红色。研究人员用激光照射小鼠的降结肠,以标记追踪结肠道白细胞如何从肠道转移到肠外组织。结果发现,受损的肌肉中,确实出现了结肠来源的Treg细胞。
TCR测序的方法也证明,在肌肉愈合过程中,小鼠肠道和肌肉中的Treg细胞属于相同的克隆群,再次表明这些Treg细胞起源于肠道并传播到肌肉。
研究人员还发现,Treg细胞不仅进入肌肉,还会转移到身体的其他部位。在稳态条件下,结肠中产生的表达RORγ的Treg细胞亚群(和其他亚群)会不断离开结肠,并通过肠外淋巴和非淋巴器官进行重新分布。这些Treg细胞将依据TCR能否识别“当地”的抗原,选择在不同的地方“安家落户”。另一方面,肌肉损伤会诱使一些炎症刺激物释放,这促进了表达RORγ的Treg细胞的募集,而那些能够识别肌肉抗原的Treg细胞将优先增殖并保留下来。
03
肠道微生物促进Treg细胞在肌肉中聚集,抑制炎症因子IL-17生产
为了弄清楚Treg细胞在肌肉修复中所起的作用,研究人员使用了缺乏RORγ+ Treg细胞的基因工程小鼠。结果发现,这些小鼠愈合速度更慢,且出现了纤维化。使用流式细胞术,他们发现与正常小鼠相比,这些小鼠受伤后的伤口中有更高水平的IL-17。IL-17是一种一种炎症细胞因子,若不能在肌肉再生过程中及时调节IL-17的产生,将会损害肌肉卫星细胞的分化,从而有碍肌肉再生。
研究人员还发现了肠道微生物对RORγ+ Treg细胞的影响。在无菌环境中长大的小鼠或在使用抗生素的小鼠身上,肌肉中RORγ+ Treg细胞的积聚降低,伤口不能正常愈合,且出现纤维化。此外,研究人员还发现,必须是特定的微生物群才能促进Treg细胞的积聚,比如梭状芽孢杆菌可以,而大消化链球菌不能。这是由于,Treg细胞在肠道中被特定食物和细菌产生的抗原所激活了,否则Treg细胞将仍处于初始的静息状态。
令人惊喜的是,这一机制在其他形式的愈合中也起到作用。除了肌肉损伤,这些微生物群激活的Treg细胞还能帮助治愈肝脏损伤。在非酒精性脂肪肝(non-alcoholic steatohepatitis,NASH)小鼠模型中,IL-17是公认的驱动NASH疾病进展的因素,而Treg细胞对炎症起到的减缓作用同样取决于微生物群是否存在。
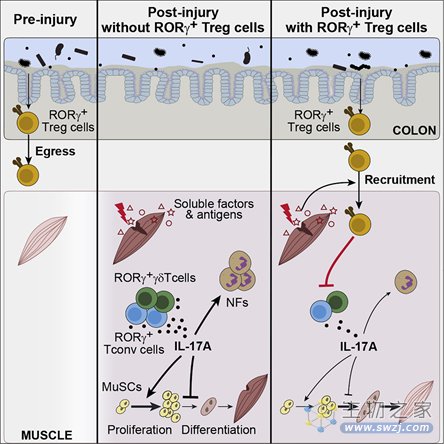
图2 肠道微生物群通过激活Treg细胞促进肌肉愈合(图源:[1])
研究的第一作者、哈佛医学院的免疫学家Bola Hanna表示:“微生物群对我们免疫系统和整体健康的影响超乎以往认知。这项研究提醒我们,在使用抗生素进行治疗时需要格外注意。由于结肠Treg细胞高度依赖于微生物群,在组织损伤时,必须谨慎判断是否使用抗生素。”此外,IL-17还与自身免疫性疾病和肿瘤发生增加有关,这意味着肠道微生物群可能也在其他炎症性疾病中发挥作用。
免疫学家Alexander Rudensky评价这项研究说:“发现肠道内的免疫细胞群具有全身效应,能够影响其他地方发生的生理和病理生理过程,这显然是一个重要的研究课题。它为进一步探索肠道中产生的细胞可能影响生理学的其他方面奠定了基础。”
参考资料:
[1]Bola S. Hanna, Gang Wang, Silvia Galván-Peña,et al, The gut microbiota promotes distal tissue regeneration via RORγ+ regulatory T cell emissaries, Immunity, 2023, ISSN 1074-7613, https://doi.org/10.1016/j.immuni.2023.01.033.
[2]https://www.the-scientist.com/news-opinion/gut-bacteria-help-t-cells-heal-muscle-study-71007































