保持细胞、组织和个体的稳定状态对于最简单的单细胞生物到结构复杂的哺乳动物以及人类都至关重要。然而,在严酷而多变的环境中,这些稳定的状态会不断被打破。为了生存,生物体已经进化出保守的应对机制,以感应这些破坏并做出一系列反应,从而修复受损的组织以恢复生物体的稳定状态。其中,感染和创伤是几乎所有物种都可能遭遇的问题。虽然以前的研究已经深入探究了生物体和组织如何识别和应对感染,例如通过识别病毒和细菌的RNA和DNA,生物体会激活先天免疫信号通路释放一型干扰素(Type-I interferons) 来协调抵抗感染。然而,对于创伤修复,机体如何识别创伤并产生一系列应对反应以协调组织修复,还不是很清楚。我们需要进一步探究,从而更好地了解我们的机体如何应对感染和创伤的共通机制。
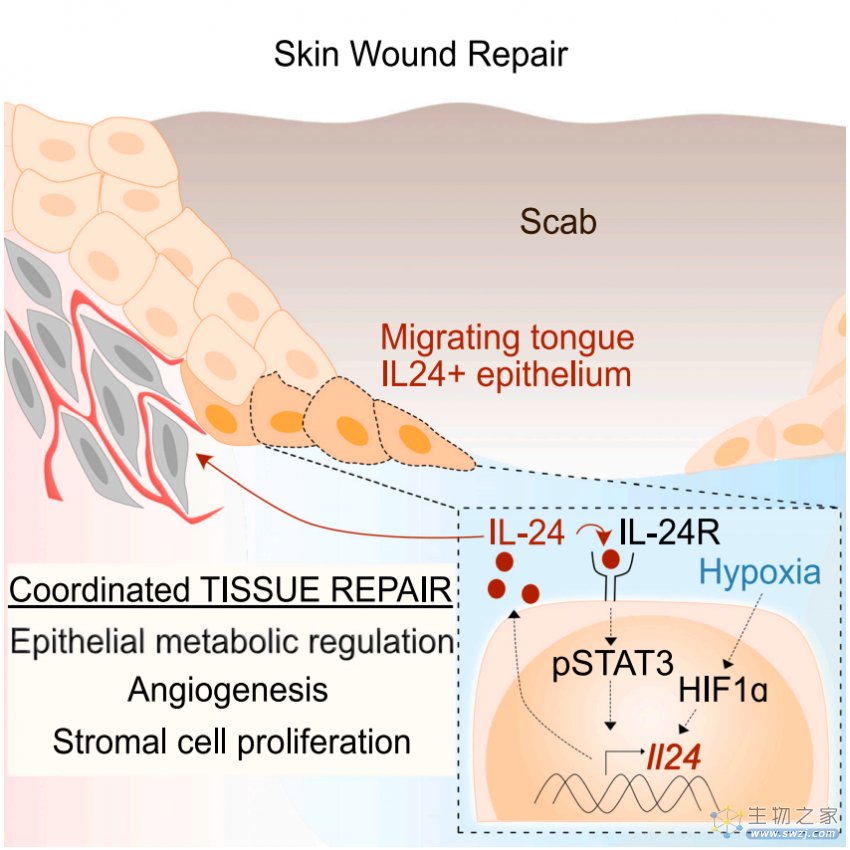
2023年4月24日,洛克菲勒大学Elaine Fuchs团队的刘思琦博士和Hun Ha Hur博士等在Cell上发表了文章A tissue injury sensing and repair pathway distinct from host pathogen defense,发现了一种新的感应组织损伤协调修复的机制,为我们深入探究这一领域提供了新的线索。在这种损伤反应中起主导作用的是一种称为白细胞介素-24(IL-24)的蛋白,当在伤口边缘的皮肤上皮干细胞感受到伤口的存在,它们便诱导释放IL-24。一旦被分泌到伤口组织中,这种蛋白就开始协调伤口里面一系列不同的细胞,从而开始复杂的伤口愈合过程。

合作者德克萨斯西南医学中心的进化生物学家从倩进行的分析显示,IL-24及其受体与能被微生物激活的干扰素家族具有密切的序列和结构同源性。这说明IL-24和干扰素信号通路可能源自同一个共同祖先。有趣的是,与干扰素不同,IL-24的激活不依赖于任何微生物和后天免疫系统。
那么是什么损伤信号激活了这一信号通路呢?伤口通常会延伸到皮肤的真皮层,伤及血管。作者发现当血管被切断并结痂时,伤口边缘的表皮干细胞会处于缺氧状态。当表皮干细胞感受到这种缺氧的状态,它们就会触发转录因子HIF1α和STAT3的正反馈回路,在伤口边缘批量生产IL-24。IL-24会作用于表达IL-24受体的多种细胞类型,通过替换受损的上皮细胞、愈合断裂的毛细血管和产生新的成纤维细胞来协调修复伤口。
刘思琦博士说,“我们的研究发现了一条重要的感应伤口并协调组织修复的先天免疫信号通路。这条创伤激活的通路和微生物激活的干扰素通路在远古时期很有可能拥有一个共同祖先。这个祖先通路也许后来分化出两种或多种不同的通路,以应对不同的微生物感染或组织损伤的特殊需要。这也说明,到现在,我们的机体运用功能相似的先天免疫通路来感知、协调和修复打破组织稳态的紧急情况”。
刘思琦博士现在在美国得克萨斯州达拉斯西南医学中心建立了自己的实验室,正在招聘博士后和研究生。实验室主要方向继续通过研究哺乳动物和人伤口如何愈和,以及先天免疫信号通路在其中所起的作用,来更深刻理解组织修复再生的以及相关疾病 (比如炎症性疾病和癌症)的原理。她的实验室会运用多种生物学技术来研究这些问题,包括生物化学,分子生物学,免疫荧光显微镜技术,小鼠遗传学和生物信息学等。欢迎志同道合的同学朋友们加入她的实验队伍。
原文链接:
https://www.cell.com/cell/fulltext/S0092-8674(23)00328-8































