胰腺癌(Pancreatic Cancer),是一种恶性程度很高,诊断和治疗都很困难的消化道恶性肿瘤,其中胰腺导管腺癌(PDAC)占全部胰腺癌的 95% 以上。近年来,胰腺癌发病率明显上升,胰腺癌早期的确诊率不高,发现时往往已是晚期,由于生存率低、预后差,胰腺癌也被称为“癌中之王”。
手术是目前治疗 PDAC 的唯一有效方法,但手术后仍有近 90% 的患者在 7-9 个月内(中位时间)复发,5 年总生存率仅为 8-10%。手术后辅助化疗能够延迟 PDAC 复发,但近 80% 的患者仍会在 14 个月左右复发,5 年总生存率<30%。而放疗、生物制剂及靶向治疗也没有效果,此外,PDAC 对免疫检查点抑制剂几乎完全不敏感(应答率<5%)。这种不敏感性部分归因于 PDAC 的突变率低,产生的新抗原(Neoantigens)很少,导致 PDAC 的抗原性弱。
然而,最近的一些研究表明,大多数 PDAC 实际上比之前预测的含有更多的新抗原。此外,对 PDAC 长期幸存者的研究表明,新抗原可能刺激 PDAC 中的 T 细胞。因此,由于大多数 PDAC 含有可能刺激 T 细胞的新抗原,递送新抗原的策略可能会诱导新抗原特异性 T 细胞,从而改善患者预后。
2023 年 5 月 10 日,纪念斯隆凯·特琳癌症中心、BioNTech、基因泰克(罗氏子公司)的研究团队合作,在国际顶尖学术期刊 Nature 上发表了题为:Personalized RNA neoantigen vaccines stimulate T cells in pancreatic cancer 的研究论文。
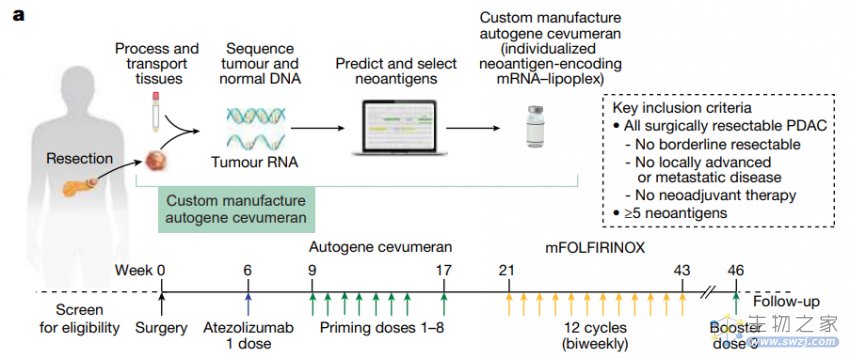
该研究开发了一种个性化 mRNA 疫苗策略——autogene cevumeran(BNT122),该疫苗通过 mRNA 表达 PDAC 患者的 20 种新抗原,使用 LNP 进行静脉注射给药。在手术切除后的 PADC 患者中,与化疗和免疫检查点疗法联用时,该 mRNA 疫苗有潜力地延缓了 PDAC 患者的复发。

治疗性 mRNA 疫苗技术促进了个性化新抗原疫苗的发展。此外,mRNA 技术可以快速开发为表达多种新抗原的个性化疫苗,激活抗原呈递细胞(APC),并且可以使用已经经过临床广泛验证的脂质纳米颗粒(LNP)进行递送。
观察到 PDAC 的长期幸存者对肿瘤特异性新抗原产生了自发 T 细胞反应,但这些反应在患者之间并不相同。研究团队希望开发一款个性化 mRNA,通过诱导新抗原特异性 T 细胞,消除肿瘤转移并延迟复发,从而为手术切除后的 PDAC 患者提供临床益处。
在这项 1 期临床试验中,研究团队结合化疗(mFOLFIRINOX 方案)和免疫检查点疗法(抗 PD-L1 单抗),为 16 名手术切除后的 PDAC 患者注射了一种个性化 mRNA 疫苗——autogene cevumeran,该疫苗表达了多达 20 种新抗原,使用脂质纳米颗粒(LNP)递送,通过静脉注射给要。
研究团队在 50% 的患者中观察到明显的 T 细胞响应,这表明该个性化 mRNA 疫苗可以引发增强的免疫反应。
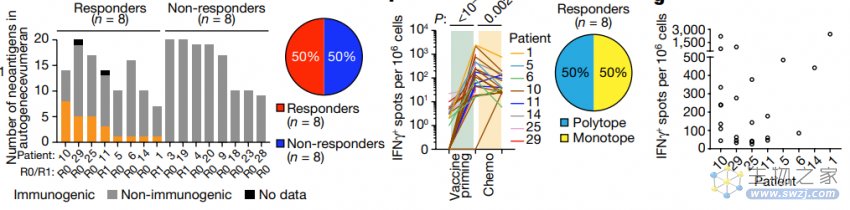
在追踪 18 个月后,患者免疫反应增强与复发时间延后有关,而对疫苗没有表现出响应的患者在初次评估后中位数 13.4 个月后出现了病情发展。
这些结果表明了个性化 mRNA 疫苗在治疗 PDAC 上的潜力,并提供了证据表明其作为一种治疗工具的一般有效性。尽管 PDAC 突变率低,但 mRNA 疫苗仍可以诱导 T 细胞活性对抗 PDAC 产生的新抗原。研究团队表示,尽管样本量有限,但这些早期结果表明有必要对这种 PDAC 疫苗进行更大范围的临床研究。
总的来说,该研究报告了初步临床试验证据,表明这种个性化 mRNA 新抗原疫苗 Autogene cevumeran(BNT122)与 Atezolizumab(抗 PD-L1 单抗)和 mFOLFIRINOX(PDAC 手术切除后的标准辅助化疗方案)联用,在手术切除的与延迟复发相关的 P DAC 患者中诱导大量 T 细胞活性。
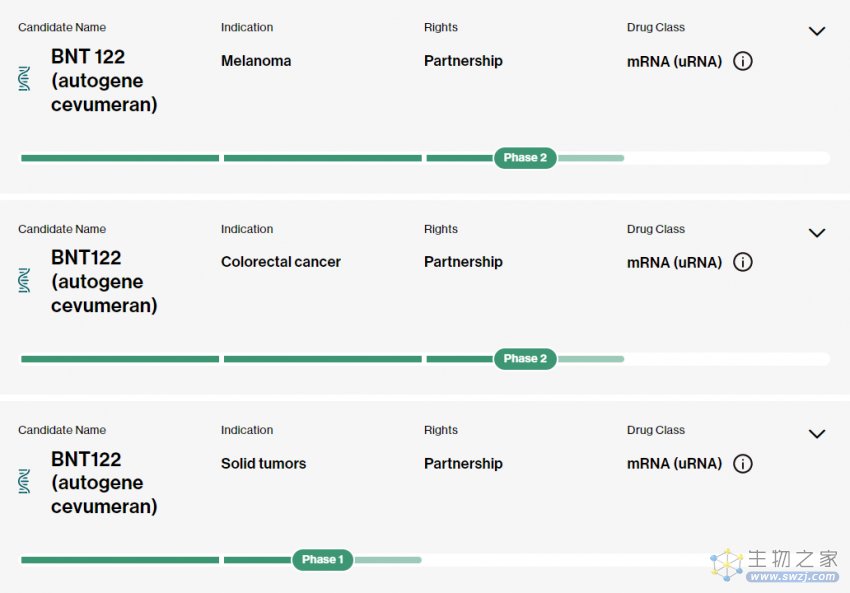
该个性化 mRNA 新抗原疫苗 Autogene cevumeran(BNT122),由 BioNTech 与罗氏子公司基因泰克共同开发,目前针对黑色素瘤和结直肠癌的治疗处于 2 期临床试验阶段,针对实体瘤的临床试验(即该论文中的研究)即将进行 2 期临床试验。
论文链接:1.https://www.nature.com/articles/s41586-023-06063-y































