蝙蝠作为一种十分奇特的哺乳动物,一直以来都吸引着很多科学家的研究兴趣,它们具有飞行能力,还可以利用回声定位,并且具有极强的病毒耐受性,包括SARS-CoV、SARS-CoV-2和MERS-CoV等。但是,目前仍缺少研究蝙蝠生物学的可靠的细胞模型。

2023年2月21日,来自美国西奈山伊坎医学院的Thomas P. Zwaka和Adolfo Garcia-Sastre以及爱尔兰都柏林大学的Emma C. Teeling联合研究团队在Cell上发表题为Bat pluripotent stem cells reveal unusual entanglement between host and viruses的文章,开发了一种可以从两种蝙蝠中诱导产生多能干细胞的方法,这些蝙蝠多能干细胞具有相似的特征,其基因表达谱类似病毒入侵后的细胞,它们也具有更多的内源病毒序列,特别是逆转录病毒。

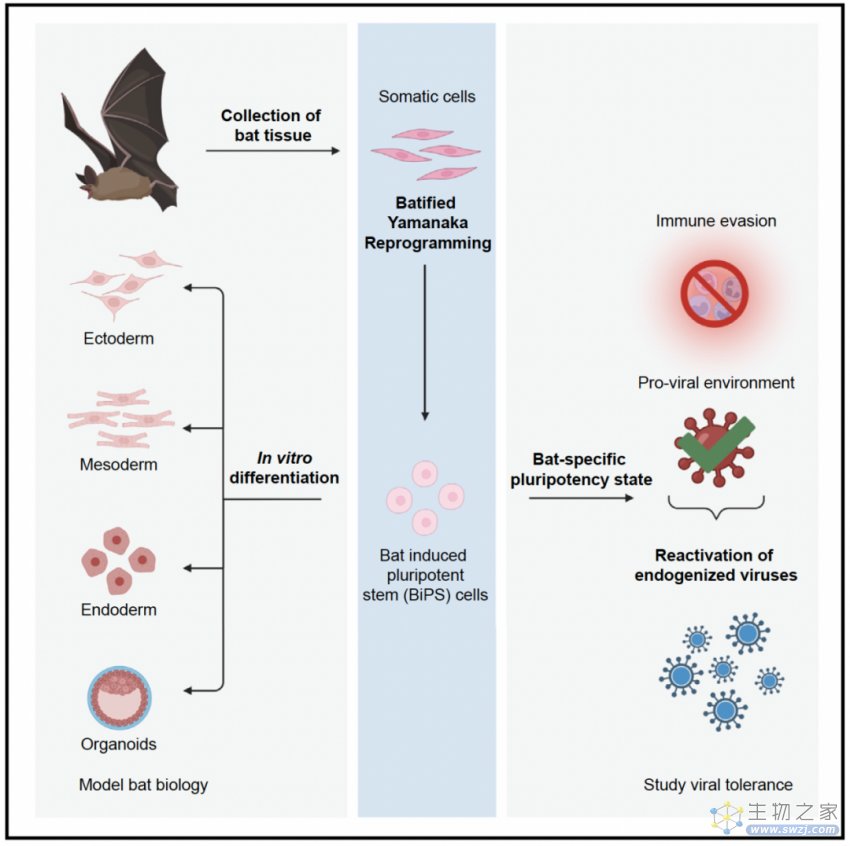
由于蝙蝠在许多领域已经成为一种新兴的模式生物,并且在传染病学中具有很大的研究潜力,于是研究人员想开发一种有效的诱导蝙蝠多能干细胞的方法。他们使用从野生的大马蹄蝠中分离得到的蝙蝠胚胎成纤维细胞(BEF),发现在人类和其他哺乳动物上可以有效诱导多能干细胞的标准方法却在蝙蝠身上失败了,只能够诱导形成初始的干细胞样克隆,但无法扩增。于是接下来他们更改了重编程因子的比例和含量,并尝试了添加不同的细胞信号通路激活剂或抑制剂,最终发现特定比例的重编程因子加上Lif、Scf、Pka激活剂白喉素和Fgf2可以在14-16天左右成功诱导出蝙蝠干细胞。
获得蝙蝠的诱导性多能干细胞(BiPSC)之后,他们对其进行研究,发现这些细胞具有一个大而明显的细胞核,其中有一到两个明显的核仁,细胞中充满小的囊泡,这些细胞表达多能因子Oct4,增殖速率与人类多能干细胞类似,并可以传超过100代而没有明显的形态变化,RNA测序显示其内源表达多能干细胞基因Oct4、Sox2和Nanog。
随后他们对BiPSC进行表观分析,结果显示蝙蝠成纤维细胞在转变成多能干细胞时,染色质构象发生显著变化,基因组上的CpG甲基化发生显著改变,多能性相关基因的表达也发生变化,总的来说这些BiPSC在转录水平和表观水平上都发生了重编程。但是基因表达和染色质修饰变化并不完全符合已知的多能性状态,因此可能存在细胞异质性或者存在一种目前未被描述过的多能性状态。此外他们还进行了功能性验证,这些BiPSC可以分化成内胚层、中胚层和外胚层,并且当移植到免疫缺陷小鼠上时可以形成畸胎瘤,不过需要4到6个月时间,形成率较低,肿瘤体积也较小,提示蝙蝠干细胞可能具有类似裸鼹鼠的抗肿瘤特性。
接下来他们将蝙蝠干细胞与其他哺乳动物的转录组进行比较,聚类结果显示大多数哺乳动物聚到一类,而蝙蝠和其他相关劳亚兽目物种聚到一类。差异最显著的是病毒基因表达、病毒转录和病毒感染后激活或抑制的基因,然后他们首先检测了蝙蝠基因组中常见的内源逆转录病毒,发现与蝙蝠成纤维细胞相比,蝙蝠干细胞的逆转录病毒表达具有明显的多样性,说明病毒已经进化出了一种可以忍受大量病毒序列存在的机制,并且其与病毒之间的关系可能比想象的更加复杂。
BiPSC为研究蝙蝠生物学提供了很好的模型
总的来说,这项研究开发了一种可以有效诱导蝙蝠iPSC的方法,从野生大马蹄蝠和大鼠耳蝠中都可以诱导出iPSC,这些iPSC的基因表达类似于被病毒攻击后的细胞,它们也具有更高的内源病毒序列数目,特别是逆转录病毒。未来利用蝙蝠iPSC及其分化后的细胞可以为研究蝙蝠生物学、病毒和宿主之间的关系以及蝙蝠特殊习性的分子基础提供有力的工具。
原文链接:https://doi.org/10.1016/j.cell.2023.01.011































